
НЕКВАНТОВЫЕ МОДЕЛИ АТОМА
5. ПЕРВЫЕ ПРЕДСТАВЛЕНИЯ О СЛОЖНОМ СТРОЕНИИ АТОМОВ
Вторая часть работы Джозефа Джона Томсона, в которой изложен упоминавшийся нами в гл. 11 метод определения отношения заряда электрона к efo массе, посвящена рассмотрению строения вещества. Из первых опытов, как мы уже говорили, следовало, что «корпускулы» обладают массой, которая несомненно значительно меньше, нежели масса самого простого атома, однако, по мнению Дж. Дж. Томсона, не меньше десятой или сотой доли массы атома водорода. Томсон считал приемлемой гипотезу Праута, согласно которой различные химические элементы представляют собой различные соединения атомов первоэлемента одной и той же природы. Если заменить атомы водорода из гипотезы Праута «корпускулами», то теория первоэлемента согласуется как с опытными данными, так и с выдвинутой в то время для объяснения особенностей спектров звезд гипотезой Нормана Локкайера.
Но как располагаются «корпускулы» в атоме? Дж. Дж. Томсон считал, что можно принять модель Босковича или даже просто модель «некоторого числа взаимоотталкивающихся частиц, сдерживаемых вместе некоторой центральной силой». К сожалению, экспериментальное изучение такого «коллектива» частиц так стремительно усложняется с ростом числа частиц, что практически становится невозможным. Поэтому целесообразнее прибегнуть к модельным представлениям, чтобы уяснить возможную структуру этих атомов, состоящих из корпускул.
По мнению Дж. Дж. Томсона, самой простой моделью следует считать модель плавающих магнитов (Опыты, проведенные в 1878-1879 гг. Майером, представляются нам интересными. В небольшой сосуд, наполненный до краев водой, помещались плавающие маленькие пробочные цилиндрики, в каждый из которых была вертикально вставлена намагниченная игла, едва выглядывавшая из пробки. Все обращенные вверх острия пгл имели одинаковую полярность. Над этими плавающими магнитами в 60 см от кончиков игл был помещен противоположный полюс вертикально расположенного цилиндрического магнита. Майер разделяет конфигурации, полученные с разным числом иголок, на группы или классы (первичные, вторичные, третичные...) и замечает, что устойчивые конфигурации одного класса образуют ядра (nuclei) последующих. С одним и тем же числом игл можно получить несколько конфигураций, одна из которых более устойчива, чем другие: колебания внешнего магнита, получаемые передвижением его по вертикали, приводят к переходу одной конфигурации в другую. Например, 29 магнитов, кроме конфигурации, указанной в тексте, позволяют получить еще более устойчивую кофигурацию, состоящую из четырех колец, которые от центра к периферии насчитывают соотвественно 1, 6, 9 и 13 магнитов. Такое поведение плавающих игл, по мнению Майера, может служить моделью структуры молекул, способной объяснить реальное поведение тел, например явления увеличения объема в некоторых случаях затвердевания, явления аллотропии и изомеризма), предложенную американцем Альфредом Майером. В этой модели магниты самопроизвольно располагаются в состоянии равновесия под действием взаимного отталкивания и силы притяжения большого магнита. Если плавающих магнитов не больше пяти, то они располагаются в вершинах правильного многоугольника; если же их больше, то они располагаются несколькими кольцами. Например, если магнитов шесть, то один помещается в центре, остальные пять его окружают, располагаясь в вершинах правильного многоугольника; если магнитов 29, то один помещается в центре, его окружает первое кольцо из 6 магнитов, второе, большее кольцо из 10 магнитов и третье, еще большее кольцо из 12 магнитов. Если принять эту систему магнитов за модель атома, причем число магнитов будет пропорционально атомному весу, то из нее сразу же следует, что если, скажем, какое-нибудь свойство зависит от числа магнитов в самом меньшем круге, то, поскольку кольцо такого типа может повторяться в нескольких моделях, появляется возможность рационального объяснения периодической системы элементов. Какая соблазнительная перспектива для физики конца прошлого века!
Но, к сожалению, эта модель смогла продержаться лишь несколько месяцев. В самом деле, ее достоверность связана с идеей о небольшом числе составляющих атом «корпускул», порядка нескольких десятков. Но если для представления строения простейшего атома требуется вообразить целое облако из тысяч «корпускул», то такая модель, очевидно, не давала бы никаких возможностей для экспериментального изучения, а может быть, и для теоретического. Вот почему, когда вскоре после этого Дж. Дж. Томсон и другие установили, что эти «корпускулы» (отныне мы будем называть их современным именем - электроны) обладают массой, во много раз меньшей массы атома водорода, Томсон вынужден был (в 1899 г.) изменить свою модель. Теперь она выглядела так: нейтральный атом содержит большое число электронов, отрицательный заряд которых компенсируется
«чем-то, что делает пространство, в котором рассеяны электроны, способным действовать так, как если бы оно имело положительный электрический заряд, равный сумме отрицательных зарядов электронов» (J. J. Thomson. On the Masses of the Ions in Gases at Low Pressures, Phil. Mag., (5), 48. 547 (1899)).
Эта вторая томсоновская модель атома все еще страдает некоторой неясностью, но по сравнению с первой это уже большой шаг вперед, потому что она признает, что атом состоит не только из электронов, но из электронов и из чего-то, точно еще не определенного, которое служит как бы центром образования атома.
6. АТОМ ТОМСОНА
Вторая модель Дж. Дж. Томсона вскоре получила более четкий характер благодаря работе лорда Кельвина, чей огромный авторитет, несомненно, сильно помог дальнейшему успеху модели Томсона. В этой работе, появившейся в 1901 г., выдвигается предположение, что поток отрицательного электричества, состоящий из электронов (которые Кельвин; пожалуй, этимологически более правильно называет электрионами по аналогии с термином ионы), свободно пронизывает не только пустое пространство между атомами, но и сами атомы. Кроме того, Кельвин постулирует притяжение между атомом обычной материи и электроном, определяемое следующим законом:
Притяжение атомом внешнего электрона обратно пропорционально квадрату расстояния между их центрами, а притяжение электрона, находящегося внутри самого атома, пропорционально расстоянию между их центрами.
Этот закон, согласно знаменитой теореме Ньютона, равносилен допущению о равномерном распределении положительного электричества в пространстве, занимаемом атомом обычной материи. Из этого следовало, что существует два рода электричества: отрицательное, «зерновидное», и положительное в виде непрерывного облака, как обычно представляли себе «флюиды», и в частности эфир.
Обычная незаряженная материя представляет собой совокупность атомов, содержащих столько электронов, сколько необходимо для того, чтобы вне атома нейтрализовать электрические силы. Короче говоря, модель атома Кельвина предполагает, что в атоме имеется равномерное сферическое распределение положительного электричества и определенное число электронов. Но при чтении статьи Кельвина нельзя понять, является ли для него так называемая материя носителем этого электрического заряда или же она отождествляется с ним. Эта же двусмысленность потом будет присуща и последующим моделям атома.
Как бы там ни было, простейшая модель атома представляет собой равномерное сферическое распределение положительного электрического заряда с одним электроном в центре. Что же касается атомов с двумя и более электронами, то здесь возникает проблема устойчивости, которую Кельвин без долгих рассуждений разрешает утверждением, что электроны, вероятно, располагаются по сферическим поверхностям, концентричным границе атома, находящимся внутри него, и, должно быть, вращаются вокруг центра.
Модель Кельвина подымала две важные проблемы. Вращающиеся электроны должны были бы, согласно электромагнитной теории света, вызывать электромагнитные волны и магнитное поле. Как проявляются оба эти явления? Изучением этого занялся Дж. Дж. Томсон и примерно в течение пятнадцати лет оставался верным модели Кельвина, которая была воспринята физиками как развитие модели Дж. Дж. Томсона и поэтому в течение первых двух десятилетий нашего века называлась «атомом Томсона».
Томсон установил сначала (1903 г.), что вращающиеся электроны должны создавать эллиптически поляризованные световые волны. Что же касается магнитного поля, создаваемого вращающимися зарядами, то, как показывала теория представление об электронах, вращающихся под действием силы, пропорциональной расстоянию, не может объяснить магнитных свойств тел, если только движение происходит без рассеяния энергии. Если допустить, что движение частиц испытывает торможение по какой-то неизвестной причине, то таким образом можно было бы объяснить парамагнетизм. Но происходит ли на самом деле рассеяние энергии? Томсон не высказывается ясно на этот счет, предчувствуя серьезные следствия, которые повлекло бы за собой такое утверждение. За год до этого Вильгельм Фохт тоже был вынужден для объяснения пара- и диамагнетизма привлечь довольно сложную гипотезу о вращающихся электронах, тормозимых в их движении постоянными соударениями. В противоположность заключениям Томсона и Фохта Пьер Ланжевен в одной чрезвычайно важной работе 1905 г., на которую все еще продолжают опираться книги по теории магнетизма, считает возможным придать гипотезе Ампера точное истолкование с помощью модели вращающихся по замкнутым траекториям электронов. Ланжевен показал также, что эффект Зеемана можно объяснить гипотезой вращающихся электронов, даже не зная закона притяжения, удерживающего электроны на орбите.
Механическая устойчивость атомной структуры была исследована Дж. Дж. Томсоном в его следующей работе в том же 1904 г. Он пришел к выводу, что электроны должны находиться в быстром вращательном движении, причем скорость их не меньше некоторой определенной предельной величины, а если электронов много (больше восьми), то они располагаются несколькими кольцами (отсюда и связь между структурой атомов и периодической системой элементов) и число электронов в каждом кольце уменьшается с уменьшением радиуса самого кольца. В радиоактивных атомах вследствие излучения скорость электронов постепенно уменьшается; когда она достигает предельной величины, устойчивость нарушается и происходит взрыв атома, в результате которого выбрасываются частицы и устанавливается новая структура атома.
Известно, что атом Томсона не устоял перед критикой и перед опытной проверкой. Но было бы неверно думать, что его исследование было бесполезно. Напротив, оно представляло собой ценное руководство для теоретических и опытных изысканий того времени и выявило основные проблемы, которые предстояло решить при любой модели атома, принимающей электроны его составной частью. Эти проблемы можно свести к трем: связь между числом и распределением электронов и массой атома; природа и распределение положительного электричества, компенсирующего общий отрицатель ный заряд электронов; природа и распределение массы атома.
Томсон понимал, что главная проблема, перед которой стоит любая модель атома, состоит в нахождении такого пути, который позволил бы по данным опыта как-то судить о числе электронов, содержащихся в атоме. И он нашел такой путь, предположив, что каждый электрон является центром рассеяния излучения, падающего на атом. Если основываться на этой гипотезе, то четыре явления позволяли получить необходимые оценки: рассеяние рентгеновских лучей, поглощение катодных лучей, дисперсия света и отклонение быстрых заряженных частиц при их прохождении через вещество.
Идя по этому пути, Дж. Дж. Томсон и многие другие исследователи, среди которых самыми известными были Краутер и Баркла, пришли к выводу, что число электронов в атоме должно быть пропорционально атомному весу. Точнее говоря, Краутер, исходя из опытов по рассеянию лучей, пришел в 1910 г. к выводу, что число электронов должно быть в 2-3 раза больше атомного веса данного элемента; Баркла же по данным о рассеянии рентгеновских лучей в 1911 г. пришел к выводу, что в легких атомах число электронов должно равняться примерно половине их атомного веса. Эти данные взаимно противоречивы, но их объединяет одно: число электронов каким-то образом связывается с массой рассматриваемого атома. Разве уже один этот качественный вывод, который впоследствии побудит других к более тщательным исследованиям, не делает атом Томсона достойным упоминания?
Гораздо труднее получить данные, необходимые для решения второй проблемы, касающейся положительного заряда атома. Здесь вопрос не столь ясен, как в случае с отрицательными зарядами. И все же, по мнению Томсона, имелись два указания на существование положительного заряда в атоме. Испускание α-частиц радиоактивными веществами заставляло предполагать, что они исходили изнутри атома, более того, они представляли собой составную часть атомов в радиоактивных элементах. А разве устойчивые элементы не могли иметь тот же состав?
«По-моему, - писал Томсон в 1913 г., - можно быть уверенным, что и другие атомы, помимо атомов радиоактивных элементов, могут быть тоже разложены и что гелий может быть получен в качестве продукта такого разложения».
Более того, - и это как раз и есть второе указание на существование положительного заряда в атоме - Томсону показалось, что он наблюдал (каким метким кажется нам замечание Гальвани о том, что часто каждый из нас видит в явлениях то, что хочет видеть!), как некоторые металлы, бомбардируемые быстрыми катодными лучами, испускали гелий. Однако этот факт был позже опровергнут Марией Кюри.
7. АТОМ НАГАОКА - РЕЗЕРФОРДА
Кельвин лишь упомянул о возможности существования внутри атома центрального положительно заряженного ядра. Эта идея, оставленная без внимания Томсоном, была развита японским физиком Хантаро Нагаока (1865-1950) в сообщении, сделанном им в декабре 1903 г. в Токийском физико-математическом обществе; в следующем году это сообщение было опубликовано в английском журнале «Nature». Томсон выдвигал свою модель, учитывая прежде всего электрические явления, тогда как Нагаока решил заняться изучением сатурноподобной системы, чтобы попытаться объяснить спектры эмиссии.
«Система, - разъясняет ученый, - состоит из большого числа частиц одинаковой массы, расположенных по кругу через равные угловые интервалы и взаимно отталкивающихся, с силой, обратно пропорциональной квадрату расстояния между ними; в центре круга помещается большая частица, которая притягивает другие частицы, образующие кольцо, по тому же закону».
Заметив, что при движении частиц вокруг центра система остается устойчивой по отношению к малым поперечным или продольным колебаниям, Нагаока добавляет:
«Очевидно, рассмотренная здесь система будет приблизительно реализована, если мы разместим электроны по кольцу, а положительный заряд в центре. Такой атом не будет противоречить результатам недавних опытов с катодными лучами, радиоактивностью и другими связанными с этим явлениями» (Н. Nagаоka, On a Dynamical System Illustrating the Spectrum Lines and the Phenomena of Radioactivity, Nature, 69, 392 (1904)).
И все же первое время модель Нагаока не имела особого успеха.
В 1908 г. Гейгер и Марсден начали экспериментальное изучение прохождения α-частиц через тонкие пластинки из золота и других металлов. Они заметили, что большинство частиц проходит через пластинку почти по прямой и продолжает дальше за пластинкой свой путь так, как будто никакого препятствия со стороны вещества и не было. Аналогичное наблюдение было проведено Уильямом Брэггом в 1904 г. Но Гейгер и Марсден заметили, что наряду с таким поведением большинства α-частиц иногда какая-нибудь частица - примерно одна из 10 000 - все же сильно отклонялась, причем отклонение было больше прямого угла.
Здесь, несомненно, речь шла о явлении столкновения а-частицы с атомами вещества. Но как в модели атома Томсона, так и в модели Нагаока предполагалось радикальное изменение понятия столкновения атомов по сравнению с тем, которое существовало в кинетической теории газов. В кинетической теории атомы уподоблялись упругим шарикам и проблемы столкновения рассматривались точно так же, как рассматривается столкновение двух бильярдных шаров. Новые модели атомов больше не допускали такого уподобления, потому что при сближении двух атомов со своими электрическими зарядами между соответствующими электрическими зарядами возникают довольно значительные силы отталкивания, изменяющие первоначальные траектории атомов: «удара» в механическом смысле не происходит. Теория, объясняющая изменение движения двух таких сильно сближающихся атомов, гораздо сложнее с математической точки зрения. В первом приближении, однако, движение двух таких атомов с соответствующими зарядами изменяется приблизительно так же, как и при механическом столкновении, поэтому можно еще продолжать говорить о столкновениях, помня, однако, что это не настоящие столкновения.
Имея все это в виду, Томсон истолковывал сильное отклонение, наблюдавшееся Гейгером и Марсденом, не как отклонение, вызванное одним-единственным столкновением α-частицы с атомом, а как сумму многочисленных мелких отклонений частицы в ее последовательных столкновениях с атомами проходимого вещества. Напрасно было бы ждать, чтобы Томсон объяснил, каким же образом последовательные мелкие отклонения направлены все в одну сторону так, что складываются в одно общее большое отклонение, которое и наблюдается.
Модель Томсона не допускала другой интерпретации опыта Гейгера и Марсдена, ибо очевидно, даже если не вникать в расчеты Томсона, что размазанный положительный электрический заряд (α-частица), проходя через другой размазанный электрический заряд с примесью электронов (атом), может претерпеть лишь незначительные отклонения.
Модель Томсона не могла удовлетворительно объяснить опыт Гейгера и Марсдена. Решить эту задачу смог в 1911 г. бывший ассистент Томсона Эрнест Резерфорд. Он пришел к убеждению, что сильное отклонение, наблюдавшееся Гейгером и Марсденом у некоторых α-частиц, должно объясняться резким отклоняющим действием, испытываемым α-частицей при прохождении через интенсивное электрическое поле атома, или, иначе говоря, в результате одного-единственного столкновения с атомом. Но если отклонение вызывается одним столкновением, то неизбежно приходится предположить, что в центре атома имеется некое ядро чрезвычайно малых размеров, заряженное положительно и заключающее в себе большую часть массы атома. Одним словом, нужно было принять модель атома Нагаока, устойчивость которого, подвергавшаяся сомнению, по мнению Резерфорда, не должна вызывать особого беспокойства, ибо этот вопрос должен рассматриваться лишь во вторую очередь, когда будет подробно изучена структура атома.
С помощью модели Нагаока сильное отклонение получает очень простое объяснение: α-частица пересекает электронную атмосферу атома металлической пластинки, приближается к ядру и благодаря большой силе кулоновского взаимодействия между двумя положительными зарядами сильно отклоняется, описывая траекторию гиперболического типа.
Ланжевен обратил внимание на то, что модель атома Нагаока как будто не совсем соответствовала данным о радиоактивных явлениях, поскольку радиоактивные вещества испускают также и β-лучи, которые, как кажется, выходят из самых глубин атома. Поэтому в атомном ядре должны находиться также и электроны, так что с этой точки зрения модель Томсона казалась более приемлемой. Мария Кюри настаивала на необходимости признать существование электронов в ядре. Эти «основные» электроны, как она их назвала, или «ядерные», как их стали называть позже, не могут быть испущены без разрушения самого атома, тогда как другие, получившие название «периферических», могут быть оторваны от атома без изменения его химической природы. В течение двадцати лет ядерные электроны считались частью атомной структуры (запоздалая дань уважения модели Томсона?). По предложению Резерфорда им была приписана функция склеивания положительных зарядов ядра, которые сила взаимного кулоновского отталкивания стремилась разделить.
Модель Нагаока - Резерфорда была лишь качественным представлением строения атома, и необходимо было перейти к количественным характеристикам, подобно тому как это было сделано для модели Томсона. Эксперименты, которые привели к выводу, что ядерный заряд равен половине атомного веса, очевидно, были применимы и к новой модели. Но Резерфорд заметил, что эта закономерность, по крайней мере для легких ядер, не вполне точна. В самом деле, трудно допустить, что отдельная α-частица, испущенная радиоактивным веществом в виде иона гелия с двумя положительными зарядами, сохраняет какой-нибудь из своих периферических электронов. Поэтому нейтральный атом гелия должен иметь два электрона, а атом водорода по аналогии - один электрон, причем заряд ядра тоже должен быть равен единице, из чего ясно, что указанный закон здесь несправедлив.
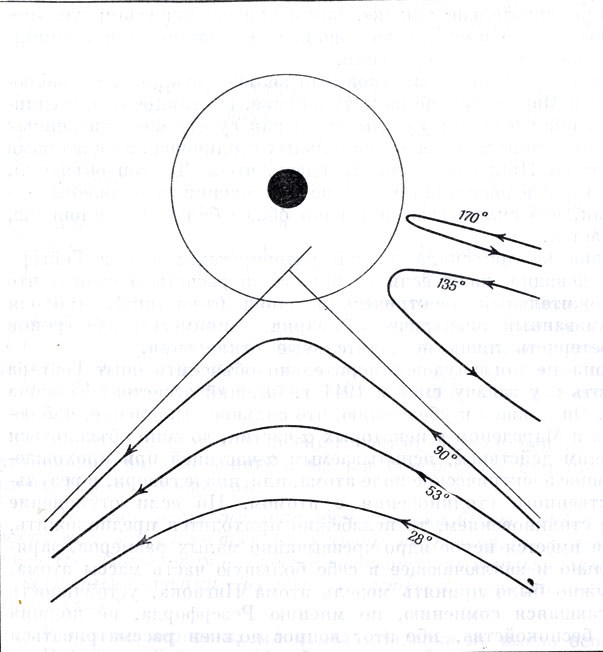
Гиперболические траектории α-частиц вблизи тяжелого ядра, по Резерфорду (1911 г.)
Решающим, или, как назвал его Содди, «драматическим», годом для модели Резерфорда был 1913 год. Четыре основных факта, установленных почти одновременно, сильно помогли уверовать в достоверность ядерной модели атома. Эти четыре факта взаимно связаны и взаимно обусловлены не только потому, что все они (за исключением одного) установлены в географически близких друг другу местах (Кембридж, Манчестер и Глазго), но и благодаря общему для всех них более или менее непосредственному влиянию самого Резерфорда. Мы уже говорили о первом из этих фактов, об экспериментальном правиле смещения, ясно сформулированном Содди весной 1913 г. Расскажем теперь об остальных трех: о понятии «атомного номера», выдвинутом незадолго до этого Ван ден Брейком (1870-1926), о квантовании электронных орбит, сформулированном Бором летом того же года, и об опытном законе Мозли, установленном зимой.
Ван ден Брейк заметил, что данные по рассеянию α-частиц лучше объясняются моделью Резерфорда, если предположить ядерный заряд равным порядковому номеру элемента в периодической системе Менделеева, названному им «атомным номером». Отношение атомного номера к атомному весу приблизительно равно 0,5 для легких атомов и постепенно уменьшается, достигая примерно 0,4 для урана, последнего элемента системы. Таким образом, идея Ван ден Брейка, не удаляясь сильно от ранее найденного экспериментального закона, обладала соблазнительной простотой.
Однако основание ее было довольно хрупким. Твердый экспериментально обоснованный фундамент ей придало лишь последнее из важных событии того года (о третьем мы будем подробно говорить в § 12) - закон Мозли.
Генри Мозли (1887-1915), безвременно погибший в сражении на полуострове Галлиполи, начал в Манчестере в качестве добровольного ассистента Резерфорда свои исследования спектров рентгеновских лучей 5 помощью незадолго до этого введенного Брэггом метода вращающегося кристалла. По словам Резерфорда, целью его исследований было решить, что существеннее для жестких рентгеновских спектров - атомный номер элемента или его атомный вес. Баркла уже показал, что достаточно жесткие рентгеновские лучи, попадая на простое вещество, порождают другие рентгеновские лучи, названные вторичными, которые однородны, т. е. имеют одну и ту же частоту, характерную для облучаемого вещества и не зависящую от частоты первичных рентгеновских лучей. Мозли измерил частоту основных спектральных линий, открытых Баркла для ряда элементов периодической системы, и нашел, что она пропорциональна квадрату числа, которое изменяется на единицу при переходе от одного элемента периодической системы к соседнему. Это был опытный факт, не предполагавший никакого теоретического представления о строении атома и о происхождении его излучения. Но он приобрел глубокий смысл, как только Мозли показал, что наблюдаемый факт может служить доказательством того, что «атому присуща некая характерная величина, которая регулярно увеличивается при переходе от атома к атому. Это количество не может быть не чем иным, как только зарядом внутреннего ядра».
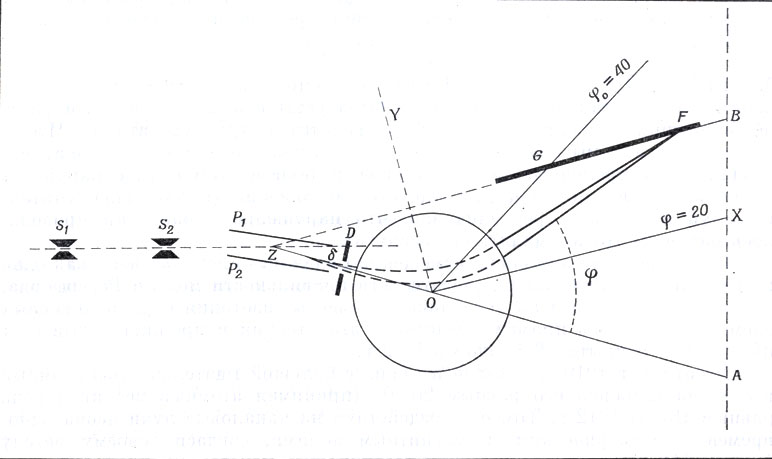
Схема первого масс-спектрографа. Ионы, вылетающие из разрядной трубки, не показанной на рисунке, проходят через щели S1, и S2, попадают в электрическое поле, создаваемое плоским конденсатором P1P2, и отклоняются вниз, Выйдя из поля, ионы проходят в щель D и попадают в магнитное поле, создаваемое цилиндрическими полюсами (показано окружностью). Магнитное поле отклоняет ионы вверх по-прежнему в плоскости рисунка. Все ионы одинаковой массы концентрируются в одной и той же точке фотопластинки GF, создавая на ней изображение. По положению этого изображения определяется масса иона
Кроме этих опытных данных Мозли, правило Содди также подтверждало простую идею Ван ден Брейка. Поскольку каждое испускание одной α-частицы уменьшает массу атома на 4, а атомный номер на 2, тогда как выбрасывание β-лучей увеличивает заряд на 1 и оставляет неизменной массу атома, то достаточно узнать тип излучения данного радиоактивного семейства и атомный номер его родоначальника, чтобы непосредственно определить атомный номер и массу всех элементов данного семейства и сопоставить их с данными опыта. Сопоставление давало результаты, полностью соответствующие теории.
Деятельная группа Резерфорда искала способ непосредственного определения величины ядерного заряда, но первая мировая война замедлила, если не совсем остановила работу, потому что тогда в отличие от положения, сложившегося в период второй мировой войны, никто не считал, что эти исследования смогут в будущем иметь какое-то военное значение; они целиком принадлежали к области «доброй старой философии», которой нужно было пожертвовать ради военных нужд. Вот почему только в 1920 г. Джемс Чэдвик произвел первое точное измерение ядерного заряда некоторых элементов, определив его по доле α-частиц, отклоняющихся на определенный угол при столкновении с атомами исследуемого элемента. Этим методом он нашел ядерные заряды для меди, серебра и платины, оказавшиеся соответственно равными 29,3; 46,3 и 77,4, а их атомные номера 29, 47 и 78; соответствие вполне удовлетворительное.
8. ИСКУССТВЕННОЕ РАСЩЕПЛЕНИЕ ЭЛЕМЕНТОВ
Факты, которые в 1913 г. придали вес модели атома Резерфорда, принадлежали главным образом к области радиоактивных явлений. Но эти явления были столь специфичны, что можно было даже допустить, что строение радиоактивных атомов отличается от строения обычных устойчивых атомов. Перенесение структуры радиоактивного атома на устойчивый атом было чистой экстраполяцией.
«Совершенно необходимо, - предупреждал Томсон в 1913 г., - устанавливать теорию строения атома на базе более широкой, чем одни лишь явления радиоактивности. Химические свойства атомов и многие физические свойства зависят от распределения электронов, находящихся вблизи поверхности атомов. Эти электроны не участвуют в радиоактивных превращениях, так что данные о радиоактивных превращениях не могут дать нам никаких указаний на их счет»(Rapports et Discussion du Conseil de Physique Solvay, 1913, p. 51).
Поэтому было бы очень важно получить какое-нибудь опытное доказательство того, что строение устойчивых атомов подобно строению радиоактивных. В 1920 г. Резерфорд попытался получить это доказательство, руководствуясь следующим чрезвычайно простым соображением, которое стоит воспроизвести буквально:
«Испускаемая радием а-частица является самым концентрированным источником энергии из всех, какими мы располагаем, и, как мы видели, имеются все основания предполагать, что α-частица радия С способна проникать внутрь ядер легких атомов, а может быть, даже тяжелых. Если только ядра атомов не представляют собой исключительно устойчивых структур, то можно ожидать, что они разрушатся под действием внутренних сил, проявляющихся в момент столкновения с частицей... Если учесть незначительные размеры ядер, то возможность центрального столкновения маловероятна, и даже в наиболее благоприятных случаях не больше одной α-частицы из 10 000 действительно производит расщепление» (Atomes et electrons, Rapports et Discussions du Conseil de Physique tenu a Bruxelles du ler au 6 avril 1921, Paris, 1923, p. 50-51).
В связи с этим Резерфорд стал пропускать через азот α-частицы, получаемые от радиоактивного вещества, или, как говорят, бомбардировал азот α-частицами. При этом он наблюдал появление ионов водорода с одним зарядом, которые Марсден наблюдал уже в 1914 г. и назвал протонами, Число полученных протонов было чрезвычайно мало: миллион α-частиц, бомбардирующих азот, едва давал 20 протонов, наблюдавшихся Резерфордом методом сцинтилляций. Полученный эффект, говорит Резерфорд,
«незначителен и с трудом поддается измерению, но в общем создается впечатление, что атомы водорода рождаются в результате расщепления ядра азота» (Atomes et electrons, Rapports et Discussions du Conseil de Physique tenu a Bruxelles du ler au 6 avril 1921, Paris, 1923, p. 50-51).
Протоны были получены также при бомбардировке α-частицами радия С других элементов (бора, фтора, натрия, алюминия, фосфора). В 1921 и 1922 гг. Резерфорд и Чэдвик осуществили другие ядерные реакции, а в 1925 г. Резерфорд истолковал все эти результаты как расщепление атомов, показав, что α-частица может быть захвачена ядром. Позднее, когда искусственные превращения уже перестали быть чем-то необычным, стало ясно, что Резерфорд в действительности добился расщепления еще в 1920 г., хотя первое время сообщения о полученных им результатах принимались сдержанно, если не скептически. Так, первый опыт Резерфорда по бомбардировке азота объясняется следующим образом: α-частица захватывается ядром азота с последующим испусканием протона и образованием ядра с массой 17, являющегося изотопом кислорода.
9. НЕРАДИОАКТИВНЫЕ ИЗОТОПЫ
Изотопия (или, как иначе говорят, изотопизм) радиоактивных элементов была установлена как опытный факт, не зависящий от каких бы то ни было гипотез о структуре атомов. Чтобы подчеркнуть это, мы упомянули о ней до того, как перешли к моделям атома, помня, что современные авторы курсов физики в этом случае нарушают хронологический порядок для удобства изложения (Содди даже считал, пожалуй несколько преувеличивая, что нарушение хронологии проводилось нарочно, чтобы умалить его заслуги).
Но после того как правило смещения Содди было использовано как одно из наиболее убедительных доказательств правильности модели Резерфорда, перенесенной также и на устойчивые элементы, изотопия нерадиоактивных элементов казалась прямым следствием этой теории и пролила новый свет яа явление, открытое Томсоном в 1912 г.
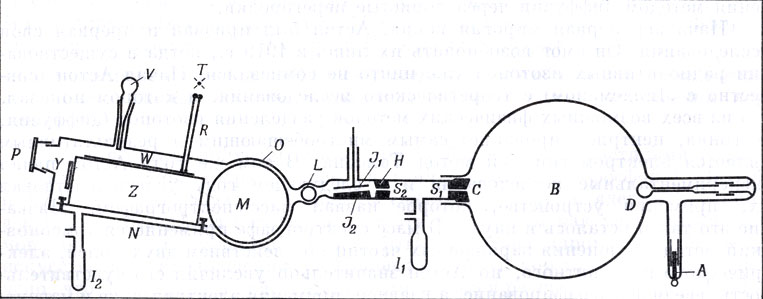
Устройство первого масс-спектрографа. B - разрядная трубка, испускающая каналовые лучи; А - анод; С - катод с отверстием; D - кремневый антикатод, служащий для сведения к минимуму рентгеновского излучения. Ионы проходят через щели S1 и S2, пересекают электростатическое поле, создаваемое плоским конденсатором J1J2 а затем магнитное поле М, и попадают на фотопластинку W; I1 и I2 - отростки, наполненные древесным углем и охлаждаемые жидким воздухом для поддержания вакуума; V - приспособление для перемещения фотопластинки
До этого, в 1910 г., Уотсон измерил с большой тщательностью атомный вес неона и нашел его равным 20,200 (принимая атомный вес кислорода равным 16). В 1912 г. Томсон, воздействуя на каналовые лучи неона одновременно электрическим и магнитным полями, согласно своему методу (см. гл. 11), заметил, что эти лучи неоднородны, потому что получались две параболы: одна, соответствующая частицам с атомным весом 20, а другая, более слабая, но все же четкая, соответствующая частицам с атомным весом 22. Томсон предположил, что атмосферный неон представлял собой смесь двух различных газов. Содди же сразу отметил:
«Это открытие представляет собой самое неожиданное приложение того, что было найдено для одного конца периодической системы, к элементу другого конца системы; оно подтверждает предположение о том, что структура материи вообще существенно сложнее, чем это проявляется в одном лишь периодическом законе»(Annual Report in Radioactivity, в сб. Annual Reports on the Progress of Chemistry, Chemical Society, London, 1913, p. 266).
В 1913 и 1914 гг. Фрэнсис Уильям Астон (1877-1945), ассистент Томсона, попытался фракционной возгонкой разделить два предполагаемых компонента атмосферного неона, однако не добился результатов. Весьма неопределенный результат дала и последующая очень трудоемкая попытка разделения методом диффузии через пористые перегородки.
Началась первая мировая война. Астон был призван и прервал свои исследования. Он смог возобновить их лишь в 1919 г., когда в существовании радиоактивных изотопов уже никто не сомневался. Начал Астон (совместно с Линдеманом) с теоретического исследования, в котором показал, что из всех возможных физических методов разделения изотопов (диффузия, возгонка, центрифугирование) самым многообещающим и результативным является электромагнитный метод Томсона. В том же году Астон начал экспериментальные исследования и в следующем году усовершенствовал их, применив устройство, которое назвал масс-спектрографом. Название это так и осталось в науке. В масс-спектрографе применяется томсоновский метод отклонения заряженных частиц под действием двух полей, электрического и магнитного, но Астон значительно увеличил его чувствительность, введя фотографирование, а главное применяя электрические и магнитные отклонения в одной и той же плоскости, но в противоположных направлениях. Впрочем, физические принципы, примененные в масс-спектрографе, общеизвестны. Ионы исследуемого вещества, проходя вначале электрическое, а затем магнитное поле, попадают на фотопластинку и оставляют на ней след. Отклонения ионов зависят от отношения e/m заряда, одинакового для всех ионов, к массе (или, лучше сказать, от nе/m, потому что ион может нести более одного элементарного заряда). Поэтому все ионы одинаковой массы концентрируются в одной и той же точке фотопластинки, а ионы с другой массой - в других точках, так что по точке попадания иона на пластинку можно определить его массу.
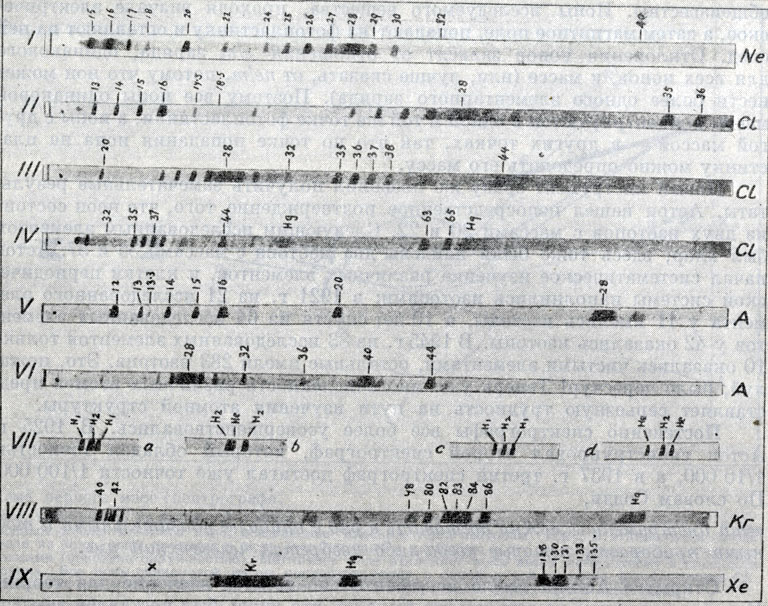
Первые фотографии спектров масс, полученные Астоном. (Philosophical Magazine, 1920.) Числа над линиями указывают соответствующие массы (масса атома кислорода принята равной 16). Линии, которые не относятся к исследуемому элементу, являются опорными линиями и принадлежат веществам с хорошо известной массой атома
Новый инструмент сразу же позволил получить замечательные результаты, Астон нашел непосредственное подтверждение того, что неон состоит из двух изотопов с массами 20 и 22. Следующим исследованным элементом был хлор; здесь тоже были найдены два изотопа с массами 35 и 37. Астон начал систематическое изучение различных элементов, и клетки периодической системы наполнились изотопами: в 1921 г. из 21 исследованного элемента у 11 имелись изотопы, а 10 лет спустя из 64 исследованных элементов у 42 оказались изотопы. В 1945г. из 83 исследованных элементов только 10 оказались чистыми элементами, остальные имели 283 изотопа. Это, пожалуй, было чересчур! Теперь уже многочисленность различных атомов представляет серьезную трудность на пути изучения атомной структуры.
Постепенно спектрографы все более усовершенствовались. В 1925 г. Астон сконструировал второй спектрограф, который обладал точностью 1/10 000, а в 1937 г. третий спектрограф достигал уже точности 1/100 000. По словам Содди,
«эти инструменты можно поставить в ряд с наиболее удивительными и точными приборами, которые когда-либо изобретал человеческий ум».
Открытие Астона имело исключительно важное значение для теории. Непосредственным следствием его было то, что вновь был поставлен вековой вопрос об определении понятия элемента. Речь идет о том, нужно ли рассматривать каждый изотоп как отличный элемент и каждое вещество, содержащее несколько изотопов, как смесь различных элементов, а не как один химически определенный элемент? Сейчас подавляющее большинство химиков продолжает придерживаться классической концепции, т. е. считает, что каждый элемент химически определяется своими химическими свойствами и своим спектром излучения при заданных условиях. Для элементов, обладающих одинаковыми химическими свойствами, но различными ядерными массами, вводится понятие и название изотопа. Другими словами, изотопы считаются элементами химически эквивалентными, но физически отличными.
Здесь впервые проявляется недостаточность периодической системы, которая годится для классификации большинства таких физических и химических свойств элементов, как объем, валентность, теплопроводность и электропроводность, т. е. тех свойств, которые называются электронными и которые зависят от числа и расположения самых внешних электронов атома. Для других же свойств, таких, как масса, радиоактивность, спектр рентгеновского излучения, которые зависят от строения ядра и от наиболее близких к нему электронов, классификация, основывающаяся на знании одного лишь атомного номера, недостаточна.
10. МАТЕРИЯ И ЭНЕРГИЯ
При проведении самых первых исследований в 1920 г. Астона и его сотрудников больше всего поразил тот факт, что атомные веса всех легких элементов представляли собой целые числа, по крайней мере в пределах экспериментальных ошибок, возможных в то время, т. е. с точностью до 1/1000.
Это «правило целого числа» начинало, однако, слегка нарушаться для более тяжелых атомов - с номера 30 и дальше, для которых отклонение от этого правила, правда незначительное, неуклонно возрастало с атомным номером. Правило целого числа, заключает Астон, придает соблазнительную простоту нашему представлению об атомном весе. Это правило реабилитирует гипотезу, выдвинутую в 1816 г. Праутом: первоэлемент «протил», из которого составлены все остальные элементы, это не водород, как думал Праут, а протон, сочетающийся с частицей, примерно в две тысячи раз меньшей, - с электроном. Из этого следует, что дробные числа, полученные химиками для атомных весов многих элементов, представляют собой средние взвешенные значения для смеси изотопов, из которых состоит химический элемент. Это просто случайный результат статистического усреднения, определяемый соотношением различных изотопов.
Но у правила целого числа было одно исключение - исключение, которое оказалось гораздо важнее самого правила: атомная масса водорода, определенная также и с помощью масс-спектрографа, оказывалась равной не 1 (если массу атома кислорода принять равной 16), а 1,008, как это установили химики. Разница очень незначительная, но все же ее нельзя было отнести за счет ошибок опытов, существенно меньших этой разницы.
Астону первому (1920 г.) пришла замечательная мысль объяснить эту аномалию неаддитивностью масс, которая предсказывалась сначала электронной теорией Лоренца, а затем теорией относительности. Именно в то время, т. е. около 1920 г., теория относительности, несмотря на суровую критику, которой она подвергалась, начинала приобретать популярность. Одним из следствий теории относительности является то, что масса и энергия оказываются разными аспектами одной и той же реальности и, согласно точно определенному соотношению, могут переходить одна в другую. Всего за несколько лет до открытия Астона известнейшие физики считали эквивалентность массы и энергии одной из самых парадоксальных шуток теории относительности (см. гл. 12). Однако Астон находит в принципе относительности объяснение отклонения массы водорода от целого числа. По мнению Астона, когда несколько протонов соединяются, образуя атомное ядро элемента, часть их массы переходит в энергию связи ядра. Это явление, названное Астоном «packing effect» («эффект упаковки») и называемое теперь дефектом массы, объясняет кажущуюся потерю массы ядра водорода при его соединении с другими ядрами и образовании нового ядра. Едва ли следует упоминать о том, что это объяснение дефекта массы сегодня есть краеугольный камень теории ядра, все еще далеко не завершенной.
«Теория показывает, - писал Астон в своей Нобелевской лекции,- что когда имеет место такая тесная упаковка, то эффективная масса уменьшается. Таким образом, при упаковке четырех протонов с двумя электронами в ядре гелия вес этого ядра несколько меньше учетверенного веса ядра водорода. Давно известно, что атомный вес водорода больше одной четвертой веса гелия, но до тех пор, пока были приняты дробные атомные веса, не было никакой нужды объяснять этот факт и из него нельзя было извлечь никакого определенного вывода. Результаты, полученные с помощью масс-спектрографа, устранили всякие сомнения в этом вопросе, так что уменьшение массы в результате упаковки не подлежит больше обсуждению. Мы можем быть совершенно уверены в том, что при превращении водорода в гелий определенная часть массы должна исчезнуть. Космологическое значение этого вывода огромно, и открываемые им возможности для будущего очень важны, важнее, чем любое другое научное открытие, сделанное до сих пор человечеством.
Мы знаем из теории относительности Эйнштейна, что масса и энергия переходят друг в друга и что в единицах СГС масса покоя т может быть выражена как некое количество энергии mс2, где с - скорость света. Даже при самых малых массах эта энергия огромна. Потеря массы даже в одном-единственном ядре гелия эквивалентна энергии, получаемой электрическим зарядом е при прохождении им разности потенциалов примерно в тридцать миллионов вольт. Если же рассматривать не один атом, а обычные количества вещества, то величина энергии становится колоссальной.
Рассмотрим, например, один грамм-атом водорода, т. е. количество водорода, содержащееся в 9 г воды. Если это количество водорода целиком превращается в гелий, то величина освобожденной энергии равна
0,0077•9•1020=6,93•1018 эрг.
Выраженная в виде теплоты, эта энергия равняется 1,11•1011 кал, а в виде работы - 200000 квт-час. Перед нами источник энергии, достаточный для объяснения происхождения тепла, излучаемого Солнцем. По этому поводу Эддингтон замечает, что если бы лишь 10% всего водорода, имеющегося на Солнце, превратилось в гелий, то освободилась бы энергия, достаточная для того, чтобы поддерживать сегодняшний уровень радиации Солнца в течение миллиарда лет.
Возможно, будущие исследователи откроют какой-нибудь способ освобождения этой энергии, который позволит ее использовать. Тогда человечество получит в свое распоряжение такие возможности, которые превосходят любую фантазию. Но нужно, однако, все время помнить о том, что освобожденная энергия может оказаться совершенно неконтролируемой и благодаря своей огромной силе произвести взрыв всего окружающего вещества. В этом случае весь водород Земли внезапно превратится в энергию и успех этого эксперимента предстанет перед Вселенной в виде вновь появившейся звезды» (F. W. Aston, Mass-spectra and isotopes, Nobel Lecture, Les Prix Nobel en 1922, Stockholm, 1923, p. 13, 14).
За два года (1919 и 1920) решение частной задачи об атомной массе неона привело к пересмотру одной из самых важных космологических проблем. Этот факт может показать, насколько важным было открытие изотопов для всех наук, а не только для физики: для великих открытий характерно сведение к одному и тому же принципу явлений, кажущихся очень далекими друг от друга.
|
ПОИСК:
|
© NPLIT.RU, 2001-2021
При использовании материалов сайта активная ссылка обязательна:
http://nplit.ru/ 'Библиотека юного исследователя'
При использовании материалов сайта активная ссылка обязательна:
http://nplit.ru/ 'Библиотека юного исследователя'