
Система химических обозначений, созданная Жераром
Итак, с началом крушения дуалистической системы возник вопрос о новых критериях классификации органических соединений. Химическая практика требовала, чтобы классификация исходила из химических свойств соединений и генетических связей, опиралась на единые химические формулы, которые выводились бы из объективных эмпирических данных, а не из гипотез о внутренних группировках атомов. Именно в такой обстановке рождается система Жерара — попытка создать естественную и рациональную классификацию органических веществ.
Уже в первых работах Жерара проявляется его склонность к обобщениям и систематизации эмпирического материала. Так, в 1835 г. он подвергает пересмотру формулы природных силикатов [2] и предлагает свою классификацию этих соединений. Эта работа восемнадцатилетнего Жерара получила положительную оценку маститого Берцелиуса: «Жерар проделал весьма похвальную работу, пересчитав результаты анализов большого числа природных силикатов, чтоб сравнить с принятыми для них формулами. Он обнаружил, таким образом, много ошибок, более или менее значительных, которые являлись или ошибками расчета, или опечатками, переписанными различными авторами друг у друга. Кроме этой кропотливой и полезной работы, он еще способствовал установлению новых формул» [3, стр. 165].
В начале своей педагогической деятельности Жерар невольно был вынужден обратить внимание на отсутствие единой классификации органических веществ. Исходя из опытных данных о разложениях и превращениях органических веществ, он приходит к важным теоретическим выводам о химических формулах органических соединений и о системе атомных весов. «Я доказываю, — пишет молодой ученый, — что химик делает противоположное тому, что делает живая природа: он сжигает, разрушает, действует методом анализа. Только жизненная сила действует методом синтеза, она восстанавливает здание, разрушенное химическими силами. Отсюда следует, что хорошая классификация может быть создана на основе продуктов разложения веществ» [33, стр. 498]. Далее Жерар указывает, что при окислении или разложении органических веществ всегда выделяются угольная кислота C4O4 и вода H4O2, а при разложении азотистых соединений — еще и аммиак N2H6 (Знак Az, принятый во Франции для азота, мы везде заменили международным знаком N). Здесь Жерар пользуется удвоенными формулами, принимая С = 6 (система Дюма). Так, разложение бензойной кислоты он изображает
C28Hl2O4 = C4O4 + C24Hl2.
В системе Либиха и Берцелиуса, где С = 12, эта реакция выражалась иначе.
C14H12O4 = C2O4 + Cl2Hl2
(а в современных формулах эта же реакция выглядит так: С7Н6O2 = СO2 + С6Н6).
Жерар замечает, что молекулярный объем C4O4, H4O2 и N2H6 в газообразном состоянии равен четырем. Поскольку угольная кислота и вода имеют такой же объем, как и всеми признанный эквивалент аммиака, значит их истинными эквивалентами будут С4O4 (В системе Дюма двуокись углерода обозначалась С2O2, а окись углерода - С2O (С - 6,0 - 16)) и H4O2. Отсюда он делает вывод, что понятия «эквивалент» и «объем» тождественны. Исходя из этого, Жерар отвергает формулу НО для воды, которую принимали сторонники системы эквивалентов (формула H4О2 соответствовала 2Н2O в системе Берцелиуса), и считает, что эквивалент (молекула) воды состоит из одного эквивалента (O2) кислорода и двух эквивалентов (O2) водорода, ибо если O2 соответствует одному объему, то H4 соответствует двум объемам. Он пишет: «Вода содержит 2 эквивалента, или атома, или объема, водорода и 1 эквивалент, или атом, или объем кислорода; ее формула должна быть Н2O (Н = 12,5, O = 200)» [9, т. I, стр. 313]. Таким образом, Жерар, хотя и смешивая понятия атома и эквивалента, возвращается к формуле воды H2O, впервые предложенной Авогадро и применявшейся к системе Берцелиуса 1826 г.
По мнению Жерара, во всех химических формулах имеется только четное число атомов кислорода. Кроме этого, при разложении органического вещества никогда не выделяется С2O2, С6О6 или С10О10, а всегда С4O4 (в современных формулах 2СО2 или 2nСO2) или кратное ему количество. «Не только эквивалент угольной кислоты будет С4O4 и, следовательно, окись углерода С4O2, но по этим же соображениям эквивалент углерода будет С4 = 150, если принять O = 100. Но мы сейчас увидим, ч,то согласно нашему обозначению эквивалент кислорода будет O2 = 200, эквивалент водорода = 12,5; так что формулы С4O4 и С4O2 будут изображаться в эквивалентах таким образом: окись углерода СО = 350; угольная кислота СO2 = 550; Н = 12,5» (Если вместо Н = 12,5 взять Н = 1, то получится, что О = 16, С - 12, СО = = 28, С02 - 44). Жерар считает, что его новые формулы подтверждают правильность водородной теории кислот: «Если в действительности эквивалент воды Н4O2<...> то конституция солей, принятая всеми химиками, не может быть признанной, ибо тогда, например, свободная уксусная кислота уже никак не может быть ацетатом воды С8Н3О3•Н2O (С = 6), так как Н2O будет только половиной эквивалента воды. В этом отношении только теория типов находится в соответствии с опытом» [9, т. I, стр. 314]. Этот вывод привел Жерара к необходимости изменить атомные веса металлов. Так, исходя из своих правил, он пишет реакции образования уксуснокислого и сернокислого свинца следующим образом:
2С8Н8O4 + Рb2О2 = 2С8(Н6РЬ)O4 + Н4O2
S2H4O8 + Рb2O2 = S2Рb2O8 + Н4O2
Формула R2O2 для окислов металлов при О = 100 становится R2O при О = 200. Исходя из этого, Жерар считает нужным и «эквиваленты» металлов уменьшить вдвое по сравнению со значениями, которые они имели в системе эквивалентов или в системе Берцелиуса. Дело в том, что обе эти системы исходили из формулы RO для низших окислов металлов.
Поскольку все химические формулы должны соответствовать тому же объему, что и С4O4 и Н4O2 (т. е. четырем объемам, если принять, что объем одного атома Н равен 1), Жерар предлагает исправить те формулы органических соединений, которые отклонялись из этого правила: например, удвоить формулы щавелевой кислоты и этилового эфира, соответствовавшие двум объемам.
Таким образом, Жерар вводит объективный критерий для установления химических формул — они должны соответствовать четырем объемам. Но это положение он дополняет правилом: в формуле органического соединения число атомов углерода должно делиться на 4(С = 6), или на 2 (С = 12), число атомов водорода — на 4, а число атомов кислорода — на 2. Это так называемый закон четности или закон четных паев. В действительности это правило справедливо только для соединений, не содержащих азота. Оно является следствием удвоения формул органических соединений, не содержащих азота. Оно является следствием удвоения формул органических соединений, четырехвалентности атома углерода и четности суммы всех единиц валентностей атомов элементов, образующих соединений.
Новая классификация органических соединений, по мнению Жерара, должна исходить, во-первых, из правильных химических формул (четырехобъемных) и, во-вторых, устанавливать формулы надо путем постепенного разрушения более сложных объединений. Эти принципы классификации Жерар развил и применил в «Кратком учебнике органической химии» [12].
Главным же выводом рассматриваемой работы Жерара явилось предложение унифицировать все формулы органических соединений, а именно: считать объемы молекул всех соединений в газообразном состоянии одинаковыми. Одновременно он предлагал изменить атомные веса («эквиваленты») некоторых элементов, например, следующим образом:

Он предлагал изменить атомные веса («эквиваленты») некоторых элементов
Согласно новым эквивалентам воды и кислорода (по сравнению с эквивалентом водорода 12,5), пишет он, «плотности простых газов становятся пропорциональными их эквивалентам» [9, т. I, 314].
Несмотря на то, что Жерар смешивал понятия «эквивалент», «атомный вес» и «молекулярный вес», этот весьма важный вывод способствовал сближению его новых «эквивалентов» с атомными весами Берцелиуса (1826) и возрождению объемного метода Авогадро. Жерар пришел к этому стихийно, исходя из чисто химических соображений в области органической химии. Его система атомных весов и химических формул явилась следствием развития унитарных идей Лорана и Дюма.
Как мы уже писали, новые идеи Жерара были приняты в штыки Парижской академией наук (стр. 23). Берцелиус в годовом отчете об успехах химии посвятил работе Жерара несколько полных пренебрежения строчек: «Жерар применяет весьма удобный метод создавать теории, главное преимущество которого состоит в том, что все известные факты, которые не согласуются с его теорией, объявляются неверными» [1, стр. 327]. Столь отрицательное отношение Берцелиуса объясняется тем, что идеи Жерара расшатывали все здание дуализма, хотя предложенные им атомные веса были близки к атомным весам Берцелиуса.
Более странным кажется отношение Дюма, который предложил Жерару выбросить всю теоретическую часть его статьи. Ведь Дюма был одним из первых, кто выступил против электрохимической теории Берцелиуса, он был единственным членом академии, понимавшим передовое значение идей Жерара для развития унитарного направления.
Жерара поддержали только его друзья — Малагути и Каур (с Лораном Жерар тогда еще не был знаком). Правда, Каур указал Жерару на то, что форма изложения его статьи производит отрицательное впечатление. Каур, очевидно, имел в виду нескромность и категоричность выражений Жерара — «я утверждаю», «я доказываю», «этот атомный вес неверен», «данная формула ложна» и т. д. Многие общепринятые формулы Жерар объявлял неверными, не учитывая того, что некоторые из них были установлены членами академии, слушавшими его выступление. Так, например, он объявил ошибочными формулы стрихнина и кодеина, установленные Реньо, чем тот, конечно, был возмущен. Но все же истинными причинами враждебного отношения к прогрессивным идеям Жерара были косность и рутина большинства академиков, которые не представляли себе химию без дуализма.
Их враждебное отношение не остановило Жерара, он продолжал развивать свои идеи, будучи твердо убежденным в их правильности. В январе 1843 г. он сообщает Кауру о том, что несколько изменил свою систему эквивалентов: «Мои идеи об эквивалентах были бы, возможно, лучше приняты, если вместо того, чтобы исходить из органической химии, я исходил бы из минеральной химии, ибо я должен был сохранить О = 100. Но тогда пришлось бы уменьшить вдвое почти все наши формулы органической химии. Вот, например, несколько тел, выраженных таким образом согласно истинным эквивалентам (...)
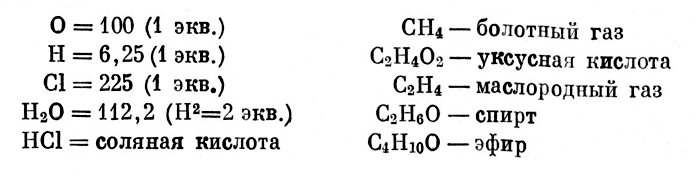
Вот, например, несколько тел, выраженных таким образом согласно истинным эквивалентам
Вы позже увидите, что я прав» [9, т. II, стр. 29]. Здесь Жерар впервые предлагает исходить из двухобъемных формул для всех соединений и в связи с этим уменьшить вдвое общепринятые тогда формулы большинства органических соединений.
В этом же письме Жерар касается статьи Дюма [14] о гомологии жирных кислот, опубликованной в ноябре 1842 г., т. е. после статьи Жерара: «Закон Дюма о жирных кислотах полностью согласуется с моими идеями. По его мнению, эти кислоты образуются добавлением или отнятием С4Н4 (В современных обозначениях C1H4 соответствует СН2) (С4 = 1 экв., Н4 = 2 экв.), а Вы ведь знаете, что в телах, не содержащих азота, я всегда допускаю четное число эквивалентов водорода, так как этот водород происходит из воды (Н4O2)» [9, т. II, стр. 29]. В мае 1843 г. Дюма опубликовал более подробное исследование об органических кислотах [15], где указал, что его выводы согласуются с выводами Жерара. По мнению Тиффено, Дюма пришел к открытию гомологии жирных кислот под влиянием системы эквивалентов Жерара и предполагает, что Дюма узнал об этой системе еще в июле 1842 г. от Каура которому Жерар писал о ней в мае того же года [9, т. 2, стр. 18].
Вторую статью на эту же тему Жерар опубликовал в июне 1843 г. В ней он подробно изложил свою систему в новом виде. Он сообщает, что из его исследований вытекают два вывода: «или H4O2 и C4O2 выражают один эквивалент, или они выражают два эквивалента. В случае первой гипотезы надо было бы удвоить формулы минеральной химии для того, чтобы они согласовывались с органическими формулами; во втором случае надо было бы уменьшить вдвое большинство формул органических соединений» [9, т. 1, стр. 316]. Сам Жерар склоняется ко второму выводу, ибо формулы органических соединений удваивались искусственно из-за дуалистического подхода к строению (конституции, как тогда говорили) солей. Так критическое отношение к принципам дуализма привело Жерара к правильному решению.
Для установления формулы уксусной кислоты, пишет он, исходили из количества серебра, получаемого при прокаливании уксуснокислого серебра. Отсюда определяли вес «эквивалента» окиси серебра, приписывая ей формулу AgO: «эквивалент» соли устанавливали, считая соль состоящей из окисла и «кислоты». Так, формулу уксуснокислого серебра изображали С4Н6O3•AgO(C4H6O4Ag), приписывая серебру удвоенный атомный вес. «Если бы считали формулу воды и формулу соответствующих окислов металлов R2O, а не RO, то наиболее естественный путь, по которому надо следовать, например в случае уксусной кислоты, — это считать эквивалентом органического вещества то количество соли, которое содержит один эквивалент металла (половину R2): уксусная кислота С2Н4O2; уксуснокислое серебро C2(H3Ag)O2; хлоруксусная кислота С2(Сl3Н)O2; хлоруксусное серебро C2(Cl3Ag)O2» [9, т. I, стр. 317]. Жерар указывает, что новые формулы говорят в пользу водородной теории кислот, ибо, например, новая формула хлоруксусной кислоты ясно показывает, что нельзя допускать предсуществование воды в кислоте, а новая формула уксуснокислого серебра — на невозможность существования в нем окиси серебра, ибо окись серебра имеет формулу Ag2O.
Жерар, конечно, ошибался, приписывая всем окислам металлов формулу R2O, по аналогии с Н2O, но то, что он в принципе признал возможность существования таких окислов, привело ко многим важным следствиям. Прежде всего это помогло ему правильно разграничить кислоты по их основности. Поскольку хлористоводородная, бромистоводородная, азотная кислоты — одноосновны, он предложил уменьшить принятые для них формулы вдвое (НСl, НВr, HNO3, вместо Н2Сl2, H2Br2, N2H2O6). Далее Жерар приводит следующую таблицу:

Далее Жерар приводит следующую таблицу
«Надо полностью изменить наши определения кислот и солей, — пишет он. — Я называю солью всякую молекулярную систему, заключающую определенное число эквивалентов водорода или металла, которые могут быть замещены непосредственно или путем двойного разложения таким же числом эквивалентов другого металла или водорода. Эквиваленты водорода или металла, которые могут таким образом замещаться, называются основанием соли» l», [9, т. 1, стр. 321]. Одноосновные соли содержат один эквивалент металла, двуосновные - два и т. д. Таким образом, терар причисляет кислоты к солям, ибо, последовательно фименяя теорию типов Дюма, считает, что кислоты и соли принадлежат к одному и тому же типу. Основанием н считает не окислы металлов, а металлы или водород. Идеи водородной теории кислот Жерар развивает более последовательно, чем Либих. Если последний ограничился только органическими кислотами, то Жерар, не признавая теории радикалов и рассматривая кислоты и соли унитарно, не видит причин не применять водородную теорию ко всем кислотам. Жерар идет дальше и в вопросе об основности кислот. Либих считал серную хромовую и угольную кислоты одноосновными и рассматривал их кислые соли как соединения одной молекулы соли одной молекулой кислоты, Жерар же, исходя из своей системы, делает правильный вывод о двуосновности указанных кислот и правильно объясняет состав их кислых солей.
Среди интересных выводов второй статьи находим, между прочим, такие: «Атомы, эквиваленты и объемы — синонимы». «Плотности газов пропорциональны их эквивалентам». Еще в первой статье Жерар писал, что благодаря его системе химических формул «исчезает противоречие между теорией эквивалентов и теорией объемов. По-моему, вода состоит из 2 эквивалентов или объемов водорода и 1 эквивалента или объема кислорода» [9, т. II, стр. 20]. Он делает вывод, что эквиваленты и простых и сложных тел соответствуют одинаковому объему (сложные вещества — 2 объемам, а простые — одному). Он называет эти числа эквивалентами, ибо они получены на основе эмпирических данных о химических реакциях веществ, а не на основе каких-либо гипотез. И поскольку система атомных весов Берцелиуса исходила из объемных данных, то, естественно, Жерар не видит теперь никакого различия между атомами и эквивалентами.
Следует заметить, что в то время существовали три разных подхода к вопросу о химических обозначениях. Были сторонники системы атомных обозначений, признававшие объемные данные или не признававшие их, сторонники системы эквивалентов, категорически не признававшие объемных данных, и, наконец, сторонники системы объемных обозначений, признававшие только объемные данные без какой-либо атомистической интерпретации (например, Гей-Люссак). Жерар видел достоинство своей системы в том, что она примирила все три точки зрения, стерла грань между понятиями «эквивалент», «атом» и «объем». Здесь надо, конечно, отметить, что первое понятие отличалось от современного. Под эквивалентами понимали «соединительные веса», определяемые химическим путем, и, естественно, эквиваленты многих веществ совпадали с их атомными весами. Так получилось и тогда, когда Жерар изменил некоторые значения этих эквивалентов для неметаллов (О, С, S): их атомные веса и эквиваленты стали тождественными. Но если с неметаллами все оказалось благополучным, то изменения, предложенные Жераром для металлов, были неудачными. Атомные веса многих металлов оказались равными их эквивалентам, так как Жерар изображал формулы низших окислов всех металлов как R2O. Отсюда ясно, что изменения, предложенные Жераром, были удачными только для щелочных металлов. Таким образом, атомные веса Жерара приблизили его систему к системе Берцелиуса (за исключением атомных весов металлов).
Вывод Жерара о том, что плотность газов пропорциональна их «эквивалентам» (молекулярному весу), является важным шагом вперед, при этом данное положение он распространяет на все газообразные соединения. Конечно, его подход к этому вопросу недостаточно последователен, ибо, как мы уже говорили, определяя атомный вес элементов, он исходил из одного объема, а устанавливая формулы сложных веществ, считал молекулярный объем соединений равным двум.
Известный интерес представляет метод определения молекулярной формулы и молекулярного веса органических веществ, описанный Жераром в его «Кратком учебнике». Для этого определения Жерар рекомендовал пользоваться не только химическими методами (изучение реакций замещения, соединения и разложения), но и физическим, основанным на измерении плотности веществ в газообразном состоянии. Он писал: «Уже давно с успехом пользуются определением плотности паров летучих неразлагающихся веществ. Для того чтобы полученное опытное число согласовалось с формулой вещества, необходимо, чтобы сумма плотностей элементов данного вещества была бы почти в два раза больше этого числа. Тогда говорят, что эквивалент вещества представляет два объема паров. Если, например, формула вещества С2Н6О, тогда мы имеем:

Если, например, формула вещества С2Н6О, тогда мы имеем
Сумма 3,165⁄2=1,582 должна совпадать с числом, полученным непосредственно для плотности вещества, если принятая формула правильна» [12, стр. 57].
Таким образом, определяя молекулярный вес сложного вещества, Жерар исходил не из его плотности в газообразном состоянии (как делается теперь), а из относительной плотности элементов по воздуху. Подобно Дюма, он складывает значения плотности элементов согласно своей эмпирической формуле. Но предшественники Жера-ра для согласования теоретических данных с опытными делили сумму значений плотности обычно на 2 или на 4, Жерар же предлагает делить эту сумму всегда на два, и если результат не совпадает с опытными данными, то надо изменить формулу вещества. Такой метод определения молекулярного веса до некоторой степени произволен, так как зависит от точности анализа и от гипотетической плотности пара некоторых элементов (С, S, P, As, Si и т. д.).
Итак, предлагая свою систему атомных весов и химических формул, Жерар стихийно признал основные положения гипотезы Авогадро о равенстве числа молекул в единице объема, а также его метод определения молекулярного веса газообразных веществ. Однако Жерар еще не различал понятий «атом» и «молекула» простых веществ; работы Авогадро, Ампера и Годена ему, очевидно, не были знакомы.
Употребляя нечеткую терминологию, смешивая атом с эквивалентом и называя эквивалентом и атомный и молекулярный вес. Жерар затемнял смысл своих идей, что очень препятствовало их восприятию. Правильному разграничению основных понятий атомно-молекулярного учения и распространению гипотезы Авогадро на простые вещества много содействовал Лоран. Он неоднократно указывал Жерару на слабые места его системы, подсказывал ему направление, в котором ее надо развивать. Главным недостатком системы Жерара Лоран считал ее непоследовательность в применении принципа единой объемной основы. «Мне кажется, — пишет он Жерару, — что надо все свести к единице объема и выражать тела так:
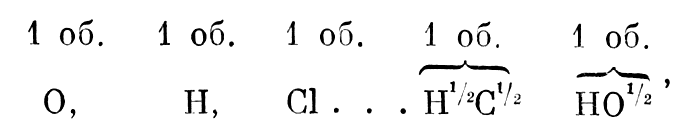
Мне кажется, — пишет он Жерару, — что надо все свести к единице объема и выражать тела так
т. е. показать, что соединение образовано путем реакции двойного разложения (или сгущения) простых реагирующих веществ... Атомы должны быть делимы. Вы мне возразите, что Вы против дробей. Но их можно избежать, употребляя какое-то условное обозначение» [9, т. I, стр. 22]. Таким образом, применяя ту же нечеткую терминологию, которой в свое время пользовался Дюма, говоря об атомах и полуатомах, Лоран фактически подходит к мысли о том, что простые газы состоят из двухатомных молекул.
В более позднем письме Лоран развивает эту идею, употребляя теперь термин молекула и полумолекула: «Из правила о постоянной четности числа эквивалентов я прихожу к важному следствию о расположении атомов. (Вы только не пугайтесь этого слова.) Водород, хлор, азот, металлы имеют двойные молекулы. Если отнимают половину одной из этих молекул, надо ее обязательно заменить полумолекулой другого тела этой же группы» [9, т. I, стр. 81]. «Существует различие между 1 объемом кислорода и 1 объемом хлора, водорода, азота... в реакцию никогда не вступает один объем хлора, водорода, но всегда два объема, из которых, правда, один может быть замещен веществом того же семейства: H2, (НСl), (МеСl) и т. д. Это точно, что нельзя замещать Н через О. Одним словом, Н не является эквивалентом О. Это смешение происходит, возможно, из-за нечеткости формулировок» [9, т. I, стр. 103].
Здесь Лоран впервые разграничивает понятия «эквивалент» и «атом». Более подробно этот вопрос Лоран рассматривает в письме от 6.IV 1846 г.: «Я вам, кажется, говорил, что не понимаю, почему только металлы привиле-гированы в том смысле, что могут иметь два эквивалента? Я думаю, что это же должно быть и у неметаллических тел. Я много думал об эквивалентах. Слова «эквиваленты», «атомы», «объемы» не могут быть синонимами. Существуют тела, между которыми нет эквивалентности... Существует эквивалентность между О, S, Se, Те; существует эквивалентность между Н, Сl, Вr, металлами. Но эти группы между собой не эквивалентны: здесь есть атомы, пропорциональные числа, но нет эквивалентов» [9, т. I, стр. 201]. Лоран фактически подошел к пониманию различной валентности элементов, хотя и не выразил этого четко. Разграничение понятий «атом» и «эквивалент» привело Лорана к пересмотру вопроса об объемах, соответствующих простым веществам. Он предлагает относить понятие «объем» только к понятию «атом». «Эквивалент <...> это количество простого вещества, которое при замещении другого простого вещества играет его роль. Не все простые вещества эквивалентны <...> Эквивалент и атом не являются, таким образом, синонимами» [9, т. I, стр. 204—205]. В таблице атомов Лоран подразделяет их на две подгруппы: «монады» и «диады»; первые, по его мнению, могут существовать в виде одного атома, а вторые (диады) только в виде двух атомов. Эти группы соответствуют нашим современным представлениям об элементах с четной и нечетной валентностью. Вот таблица Лорана
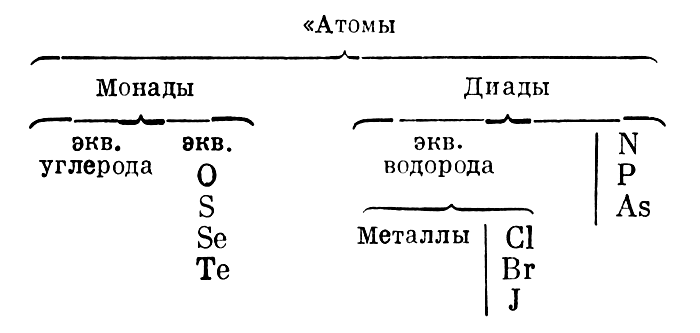
Вот таблица Лорана
Допустим, что один объем содержит один атом и что каждый атом является бинарным
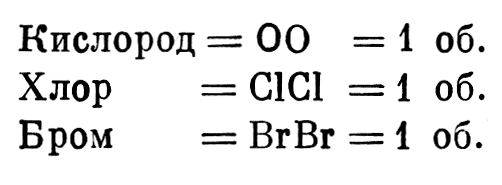
Допустим, что один объем содержит один атом и что каждый атом является бинарным
Вот что происходит между хлором и водородом:
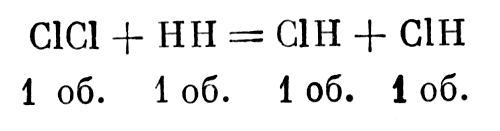
Вот что происходит между хлором и водородом
Диады всегда существуют только в четном числе (атомов)... В то же время у монад молекула такая же, как у диад, но она может существовать половинкой (в виде одного атома. — М. Ф.) без замещения» [9, т. I, стр. 205].
В этой таблице Лоран считает водород «амфидным»: атом водорода может замещаться и атомом металла, и атомом галогена.
Идея Лорана о диадах и монадах исходит из правила четности Жерара, которое Лоран дополнил правилом азота [34]. Согласно объединенному правилу, число атомов углерода и кислорода в органическом соединении (в современных формулах) может быть либо четным, либо нечетным, в то время как число атомов водорода всегда должно быть четным. Если же соединение содержит и азот, то сумма атомов водорода и азота (или фосфора, мышьяка) должна делиться на два. Впоследствии идеи Лорана в более четкой форме высказал Канншщаро [35], который доказал, что элементы и радикалы с четной валентностью могут существовать в свободном виде, а элементы или радикалы с нечетной валентностью в свободном виде существовать не могут. В 1869 г. Бломстранд создал свою классификацию элементов, подразделяя их на элементы с четной и нечетной валентностью [36].
Свои идеи Лоран подробно изложил в статье, опубликованной осенью 1846 г. Он пишет: «Если вместо того, чтобы взять, как Жерар, один объем для простых тел и два объема для сложных, мы выразим все тела как простые, так и сложные, одним объемом, мы получим более правильное обозначение <...> Мы допускаем, что каждая молекула простого тела делится по меньшей мере на две части, которые мы можем назвать атомами <...> Атом Жерара представляет наименьшее количество простого тела, которое может существовать в соединении. Моя молекула (простого вещества) представляет наименьшее количество простого тела, которое необходимо взять для получения соединения и которое делится на две части во время самой реакции. Так, хлор может входить в соединение, но для образования этого соединения надо взять Сl2» [34, стр. 295—296]. Как довод в пользу своих идей Лоран приводит понятие об активности веществ в момент выделения: «Если привести в соприкосновение две свободные молекулы брома и водорода (BrBr1) и (HH1), то сродство Вr к Br1 и Н к H1, возможно, является достаточным, чтоб воспротивиться соединению Вr и Br1 с Н и H1. Но если мы имеем в наличии только Вr + Н, то ввиду того, что эти два тела (атома. — М. Ф.) не должны разрушать никакого сродства, они могут очень легко соединиться» [34, стр. 297].
Эти цитаты выявляют то новое, что внес Лоран в систему Жерара. Чисто химическим путем он пришел к необходимости четкого разграничения понятий «атом», «молекула», «эквивалент», к более последовательному применению гипотезы Авогадро. И его путь к идее о Двуатомности молекул элементарных газов был вполне самостоятельным. Только впоследствии он подкрепил свои выводы ссылкой на гипотезу Ампера, который высказал в 1814 г. те же мысли, что и Авогадро, но тремя годами раньше.
Идеи Лорана нашли свое отражение в новом учебнике Жерара [16], где Жерар поместил специальное посвящение Лорану:
«Другу моему Огюсту Лорану, члену-корреспонденту Академии.
Посвящая Вам эту книгу, я хочу напомнить читателю, сколько хорошего в ней принадлежит Вам, и живейшее уважение, которое я чувствую к Вам.
Ш. Жерар»
В этом учебнике Жерар уже не считает молекулу и эквивалент синонимами. «Мы рассматриваем всякое тело, — пишет он, — как строение, как унитарную систему, образованную соединением в определенном, но неизвестном порядке, бесконечно малых и неделимых частиц, называемых атомами. Эта система называется частицей (molecule) тела. В частице простого тела и атомы однородны или однокачественны, т. е. современная наука не видит пока никакой разницы. В частице сложного тела атомы разнородны и разнокачественны <...> Важно установить различие между словами: атом и молекула, потому что часто их смешивают в сочинениях по химии. Атом неделим, но он и не существует в отдельном состоянии; молекула есть группа атомов, держащихся вместе притяжением материи. Эта группа делима нашими химическими или механическими средствами, но только до известной степени: частица должна состоять по меньшей мере из двух атомов» [16, стр. 32, 33]. Мы видим, что Жерар уже четко разграничивает понятия «атом», «молекула» и «эквивалент», указывает, что величина эквивалента сложного вещества зависит от того, «какому другому телу, каким отправлениям (реакциям. — М. Ф.), каким свойствам соответствует этот эквивалент», признает, что один и тот же элемент может иметь два эквивалента или несколько. При водя формулы кислот СlН, SO4H2, РO4Н3, он подчеркивает, что эквивалентные количества этих кислот будут СlН, 1/2[SO4Н2], 1/3[PO4H3]. «Химические обозначения не всегда могут изображать эквиваленты, потому что эти I последние изменяются, смотря по химическим функциям» [16, стр. 68].
Хотя Жерар под влиянием Лорана и признал, что молекулы простых веществ состоят из атомов одного рода, но он не высказался достаточно четко о числе атомов, входящих в состав таких молекул. Например, обсуждая образование СО из элементов, он пишет: «Если представить это графически, молекула углерода была бы результатом притяжения четырех сфетических атомов, сгруппированных так:

Если представить это графически, молекула углерода была бы результатом притяжения четырех сфетических атомов, сгруппированных так
Молекула кислорода состояла бы из следующих групп:
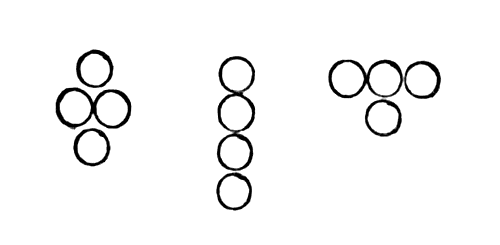
Молекула кислорода состояла бы из следующих групп
тогда молекула, составленная из атомов разного рода (из атомов кислорода и углерода), могла бы иметь одну из следующих форм:
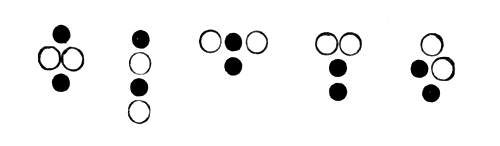
Тогда молекула, составленная из атомов разного рода (из атомов кислорода и углерода), могла бы иметь одну из следующих форм
При химическом соединении молекулы обмениваются своими атомами. Когда углерод и кислород соединяются, то частицы угля обменивают известное число атомов углерода на известное число атомов кислорода и обратно» [16, стр. 33].
Конечно, такое графическое изображение - не более как дидактическая модель, но она хорошо поясняет идею жерара о том, что все реакции надо считать реакциями двойного обменного разложения, и эта идея вытекает из нового понятия о молекуле простых веществ. Кроме того, эти модели подчеркивают отсутствие принципиального различия между молекулами простых и сложных веществ. Как видно из этих моделей, Жерар допускает многоатомность молекулы кислорода, не считая при этом окончательно установленным, что она состоит именно из двух атомов. (Надо отметить, чтотакой категоричности не было и у Авогадро, хотя он считал молекулу кислорода двухатомной).
В новом учебнике Жерар называет атомный и молекулярный вес «пропорциональными числами», а не эквивалентами, как называл в «Precis»; метод определения молекулярного веса одинакив в обоих учебниках.
Основные положения своей системы Жерар излагает в IV томе «Курса органической химии» [20]. В первых трех томах он еще пользуется системой эквивалентов, но все химические формулы сводит к одинаковому объему (4 объема). Только в IV томе он применяет свои атомные веса и двухобъемные формулы. Очевидно, Жерар поступил так, желая облегчить рядовым химикам усвоение новых формул, — ведь больше всего нареканий вызывала его попытка заменить ими общепринятые эквиваленты (Как мы говсрили, Жерар хотел применить новую систему атомных весов в немецком переводе своего учебника [21]. Однако перевод вышел в том же виде, что и оригинал.).
Лоран тоже советовал Жерару не настаивать из-за тактических соображений на новой системе атомных весов; главное внимание следует обратить на исправление неверных химических формул, тех, которые не удовлетворяют правилу четности. «Можете ли Вы удовлетвориться тем, — спрашивает Лоран друга, — что Вы будете говорить, видя какую-нибудь формулу: «Она неверна», не указывая на то, что Ваши эквиваленты привели Вас к этому выводу?» [9, т. 1, стр. 26]. Сам Лоран не решался сразу перейти к «эквивалентам» Жерара и до 1845 г. пользовался эквивалентами Дюма.
Следует отметить, что во Франции новая система обозначений Жерара не преподавалась вплоть до 1863 г., когда Делаво (Delavaud), профессор Тулонской морской медицинской школы, первым заговорил о ней с кафедры. Два года спустя появилась книга Наке (Альфред Жозеф Папе (1834-1916) - врач, химик, политический веятель, профессор медицинского факультета в Париже; в 1869 г. лишен кафедры за свои левые, убеждения. В 1887 г. примкнул к реакционному движению генерала Буланже, после его падении (в 1891 г.) отошел от политики) «Принципы химии на основе современных теорий» [37] — первый учебник, составленный по системе Жерара.
В 1866 г. расстаться с эквивалентами и применить новые атомные весы решился наконец Вюрц. По этому поводу Гримо пишет: «Если бы он это сделал раньше, министр призвал бы его к порядку» [1, стр. 433]. Однако большинство химиков Франции продолжали пользоваться системой эквивалентов вплоть до конца XIX в. Эмпирическое направление в химии, которое возглавлял такой крупный ученый, как Бертло, бывший ярым противником атомно-молекулярного учения, сыграло в этом отношении отрицательную роль. В других же странах переход к новой системе атомных весов и химических формул начался намного раньше. В России уже в 1850-х годах систему Жерара стали применять Бекетов (1853) [38] Менделеев (1856) [39], Соколов (1859) [17] и др.
После международного конгресса химиков в Карлсруэ (1860) система Жерара с предложенными иццаро исправлениями атомных весов металлов получила распространение в Италии, Англии, а несколько позже ив Германии. В 1861 г. вышел учебник Менделеева «Органическая химия», построенный по системе Жерара. Как отмечал в свое время русский ученый, уиверждение этой ситемы на конгрессе в Карлсруэ подготовило почву для открытия периодического закона химических элементов.
|
ПОИСК:
|
© NPLIT.RU, 2001-2021
При использовании материалов сайта активная ссылка обязательна:
http://nplit.ru/ 'Библиотека юного исследователя'
При использовании материалов сайта активная ссылка обязательна:
http://nplit.ru/ 'Библиотека юного исследователя'