ХИМИЯ
К настоящему времени химия - наука, рассматривающая в основном превращения веществ и, следовательно, изучающая элементы (простейшие вещества, образуемые одинаковыми атомами) и сложные вещества, состоящие из молекул (сочетаний различных атомов), - настолько развилась, а химическая промышленность стала такой огромной и многообразной, что основы химии трудно уместить даже в самостоятельной большой книге (Такие книги существуют. Одной пз лучших современных книг такого рода является кн.: Полинг Л., Полит П. Химия. М.). В настоящей книге необходимо основные этапы развития химии изложить в кратком разделе.
Выше уже говорилось о возникновении химии как самостоятельной науки. Говорилось об одном из основоположников современной химии - французском ученом Лавуазье, определившем роль кислорода в процессах горепия и дыхания, основателе термохимии, введшем в химию количественные методы анализа. Говорилось также о великом русском ученом Ломоносове, установившем неизменность количества вещества в процессе горения (закон сохранения массы), и о некоторых других крупных ученых (Бойле, Дж. Дальтоне, Авогадро, Берцелиусе, Бергмане) и их роли в создании химии и ее развитии.
Поэтому в этом разделе книги отправной точкой развития химии взято открытие великим русским ученым-химиком Дмитрием Ивановичем Менделеевым (1834 - 1907) периодического закона химических элементов, носящего его имя.
Кратко о жизни и деятельности Д. И. Менделеева. Он родился в Сибири (г. Тобольск), в семье директора гимназии. В 1855 г. окончил физико-математический факультет Главного педагогического института в Петербурге. Вел педагогическую работу (читал лекции по химии) в Петербургском университете, в 1856 г. защитил диссертацию и получил ученую степень магистра. В период 1859 - 1861 гг. находился в старейшем германском университете в г. Гейдельберге, работал в лаборатории, познакомился с находившимся там в это же время будущим известным ученым-химиком (и еще более известным в качестве выдающегося композитора) Александром Порфирьевичем Бородиным (1833 - 1887) и создавшим позднее русскую физиологическую школу Иваном Михайловичем Сеченовым (1829 - 1905), с которыми у Менделеева установились дружеские отношения. В 1861 г. Менделеев закончил работу над ставшим впоследствии широко известным учебником «Органическая химия». Возвратившись в Россию, Менделеев стал профессором Петербургского университета, а в 1865 г. защитил докторскую диссертацию.
В 1869 - 1871 гг. Менделеев написал капитальный двухтомный труд «Основы химии», вышедший только в нашей стране тринадцатью изданиями. В этом труде Менделеев изложил периодический закон элементов - свое наивысшее научное достижение.
Менделеев был не только известным ученым и педагогом, но и прогрессивным общественным деятелем. Он поддерживал борьбу студентов университета за предоставление университету большей самостоятельности и прав, за отмену полицейских функций инспекции университета.
Требования студентов не были удовлетворены, и Менделеев в знак протеста покинул университет. В 1876 г. Менделеев был избран членом-корреспондентом Петербургской Академии наук. Но в 1880 г, несмотря на большие к тому времени заслуги Менделеева перед наукой, он не был избран действительным членом академии, что вызвало возмущение общественности как в России, так и за рубежом, справедливо усмотревшей в этом отмщение за передовые взгляды Менделеева.
В 1893 г. Менделеев был назначен ученым хранителем Депо образцовых гирь и весов и работал там до конца жизни. Теперь эта организация называется Всесоюзный научно-исследовательский институт метрологии имени Д. И, Менделеева.
В жизни Менделеева всегда очень много значили эксперимент и тесная связь научных исследований с практикой, с производством. Так, например, в 1887 г., в возрасте 53 лет, Менделеев для наблюдения затмения Солнца поднимался один на воздушном шаре. Менделеев проявлял большой интерес к развитию нефтяной промышленности. Он часто посещал нефтяные промыслы в Баку, бывал в Донбассе, на Урале, на Кавказе. Большой интерес Менделеев проявлял к развитию сельского хозяйства, особенно к орошению земель на Нижней Волге, к внесению минеральных и органических удобрений.
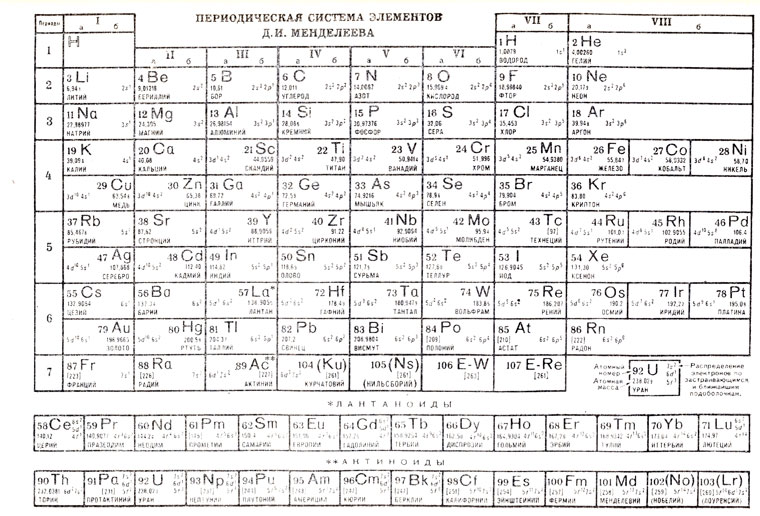
Самым крупным научным достижением Менделеева было открытие периодического закона элементов и создание периодической системы (таблицы) элементов, носящей теперь его имя (с. 413).
Еще до открытия Менделеева были сделаны попытки классификации элементов. Так, в 1811 г. Берцелиус разделил все элементы на металлы и неметаллы (металлоиды) . Металлы - элементы, которые в твердом и жидком состоянии непрозрачны, обладают особенным металлическим блеском, высокой тепло- и электропроводностью, соединяясь с кислородом образуют окислы называемые основными, а соединяясь с водой - гидраты. Металлоиды - элементы, не обладающие названными свойствами металлов. Они легко соединяются с водородом, образуя прочные газообразные (как правило) соединения. Кроме Берцелиуса, классификацией элементов занимались немецкий химик Деберейнер, французский химик, один из основателей органической химии, Дюма (Дюма принимал во внимание атомные веса элементов), и некоторые другие ученые.
Однако только в 1869 г. Менделеевым был открыт периодический закон элементов, на основе которого была создана периодическая система элементов. В своей книге «Основы химии» Менделеев писал: «У элементов есть точное измеримое и никакому сомнению не подлежащее то свойство, которое выражается в их атомном весе. Величина его показывает относительную массу атома или, если избежать понятия об атоме, величина его показывает отношение между массами, составляющими химические самостоятельные индивидуумы или элементы. А по смыслу всех точных сведений об явлениях природы масса вещества есть именно такое свойство его, от которого должны находиться в зависимости все остальные свойства, потому что все они определяются подобными же условиями или такими же силами, какие действуют в весе тела; он же прямо пропорционален массе вещества. Поэтому ближе или естественнее всего искать зависимости между свойствами и сходством элементов, с одной стороны, и атомными их весами - с другой» (Цит. по: Реформатский А. Неорганическая химия. 7-е изд., испр. и доп. М., 1912, с. 123 - 124)
Оказалось, как установил Менделеев, химические свойства элементов изменяются не непрерывно с ростом атомного веса, а периодически. Другими словами, способность элементов к химическому взаимодействию, их валентность, не увеличивается плавно с ростом атомного веса, от каждого предыдущего элемента к последующему, а после некоторого увеличения снижается, потом снова растет и так далее. Менделеев в «Основах химии» написал об этом так: «Свойства простых тел, также формы и свойства соединений элементов находятся в периодической зависимости (или, выражаясь алгебраически, образуют периодическую функцию) от величины атомных весов элементов» (Цит. по: Там же, с. 130.)
Составляя периодическую систему элементов, Менделеев расположил их по горизонталям (периоды) г, порядке увеличения атомного веса, причем так, чтобы элементы с близкими свойствами оказались в одном вертикальном столбце. Таким образом, горизонтальные строки - это периоды, а вертикальные столбцы - группы элементов, обладающих близкими свойствами. Получилось 8 групп и 12 периодов. Общее число открытых элементов составляло тогда (в 1871 г.) 63.
Мы не будем говорить здесь более подробно о таблице, составленной непосредственно Менделеевым. С тех пор прошло более 110 лет, число известных элементов возросло с 63 до 107; учение о строении атома, как известно читателю, продвинулось далеко вперед. Рассмотрим лучше несколько подробнее современную периодическую систему элементов Д. И. Менделеева.
Однако, прежде чем перейти к этому, рассмотрим еще один важный вопрос. Менделеев на основании периодической системы элементов высказал предположение о существовании некоторых, еще неизвестных тогда элементов - не все места в таблице Менделеева были заняты. Предвидение Менделеева оказалось правильным. В 1875 г. П. Лекйком де Буабодраиом был открыт новый элемент - серебристый легкоплавкий металл, названный впоследствии галлием (Ga), существование и свойства которого были предсказаны Менделеевым под наименованием экаалюмшшя. В 1879 г. Л. Нильсон открыл новый элемент-металл скандий (Sc), на существование и свойства которого также ранее указывал Менделеев, именуя его окабором. В 1886 г. К. Вжнклер открыл новый элемент, используемый теперь в качестве полупроводника,- германий (Go), названный так в честь родины Винклера; предвидя существование этого элемента, Менделеев именовал его экасилиций. Менделеев правильно предугадал существование впоследствии открытых еще семи новых элементов: технеция (Тс), рения (Re), полония (Ро), астата (At), франция (Fr), радия (Ra), протактиния (Ра).
Не правда ли, это напоминает предсказание Ньютоном (па основе проделанных ил расчетов) новой планеты Нептун, действительно открытой Галле в 1846 г. ? В обоих случаях это существенно укрепило признание новых законов: закона всемирного тяготения Ньютона и периодического закона химических элементов Менделеева.
Периодическая система элементов Д. И. Менделеева разделена на группы и периоды элементов. Каждая группа разделяется на подгруппы: основную - а и побочную - b. Элементы одной и той же подгруппы имеют сходные химические свойства. Например, элементы подгруппы Vila (галоиды) фтор (F), хлор (Сl), бром (Вr), йод (I) и астат (At) являются наиболее активными элементами среди металлоидов и поэтому очень редко встречаются в свободном состоянии. Все галоиды по отношению к водороду одновалентны и, соединяясь с ним, дают газообразные вещества типа РН. Что касается водорода (Н), то его место в периодической системе неоднозначно: он обладает свойствами, общими как с щелочными металлами (подгруппа I a), так и с галоидами (подгруппа VIIa).
Горизонтальные строки, тоже как и раньше, означают периоды элементов. Все семь периодов (исключая первый) начинаются щелочным металлом в левой части таблицы и завершаются инертным газом в правой части.
Необходимо отметить, что до тех пор, пока теория строения атома не получила должного развития, объяснить физический смысл периодической системы элементов было невозможно. Она составлялась скорее путем обобщения опытных данных, сделанного талантливым ученым, нежели путем достижений теории. Периодический закон элементов не имел научного объяснения.
Решающим моментом в раскрытии физического смысла периодической системы элементов были уже известные читателю работы Э. Резерфорда и Н. Бора, далеко продвинувшие теорию строения атома. Стало ясно, что главной характеристикой каждого элемента в периодической системе является не атомный вес, а номер элемента z, представляющий собой не что иное, как величину заряда ядра этого элемента. Поэтому в приведенном современном варианте периодической системы элементов самой крупной цифрой указывается порядковый номер данного элемента z, от первого (водород Н) до сто седьмого.
Цифрами меньшего размера указаны относительные атомные массы элементов. Поскольку элементы имеют изотопы, т. о. разновидности одного и того же элемента, отличающиеся массой атомов, образующейся за счет различного числа нейтронов в ядре атома (так как у различных изотопов одного и того же элемента заряд ядра z, а следовательно, и число электронов в оболочке атома остается неизменным, то химические свойства изотопов одного и того же элемента одинаковы), то массовые числа атомов являются дробными. Если массовое число атома дается целым, взятым в квадратные скобки, то это значит, что приведено значение массы атома превалирующего радиоактивного изотопа.
Из общего числа элементов таблицы все трансурановые элементы (z=93 - 106), а также элементы с z=43 г( технеций Тс), 61 (прометий Рт), 85 (астат At), 87 (франций Fr), получены в ядерных реакциях искусственно, на Земле большая часть из них не найдена, за исключением технеция (Тс), прометия (Рт), франция ;(Fr) н нептуния (Np), обнаруженных в очень малых количествах. Американские химики в честь Менделеева назвали открытый ими трансурановый элемент z = 101 менделевий.
Цифры и буквы, написанные мелким шрифтом, например в клетке железа (3d64s2) указывают на характер распределения электронов по застраивающимся и ближайшим подоболочкам. Мы не будем сколько-нибудь подробно останавливаться па этом вопросе. Заметим только, что расположение электронов относительно ядра атома имеет решающее значение для химических свойств, химической активности элемента, так как химическая реакция происходит главным образом вследствие изменения орбит внешних электронов и молекулы могут иметь (говоря языком планетарной модели атома Резерфорда) «общие» внешние электроны, орбиты которых проходят вокруг двух или большего числа ядер атомов элементов, образующих молекулу.
Последние две горизонтальные строки периодической системы элементов - лантаноиды и актиноиды. Лантаноиды представляют собой семейство, состоящее из 14 химических элементов, очень близких как по сбоим химическим, так и по физическим свойствам. Все они входят в число редкоземельных элементов (редкоземельных металлов) Их атомные номера z = 58-71. Они имеют весьма близкое строение электронных оболочек, химически активны, входят в побочную подгруппу III группы периодической системы элементов Менделеева.
Актиноиды - семейство радиоактивных металлов, со-втоящее также из 14 элементов с атомными номерами z = 90-103, близки между собой по строению электронных оболочек ядер атомов. Как и лантаноиды, они входят в побочную подгруппу III группы таблицы элементов. Все изотопы актиноидов обладают радиоактивностью и в своем большинстве получены искусственным путем - в результате ядерных реакций. Все актиноиды, расположенные в таблице вслед за ураном, носят название трансурановых элементов.
Каково же значение периодической системы элементов и роли Менделеева в ее создании?
Периодическая система химических элементов имела и имеет огромное значение в развитии не только химии, по и естествознания в целом. Закономерности периодической системы содействовали разработке теории строения атомов, а эта последняя решающим образом помогла создать периодическую систему в ее современном виде. Периодическая система элементов помогает решению многих задач химии, таких, например, как синтез веществ с заранее заданными свойствами пли разработка новых полупроводниковых материалов и различных катализаторов.
Великий русский ученый Д. И. Менделеев открыл один из фундаментальных законов природы - периодический закон элементов, на основании которого им была построена периодическая система элементов. Закон и система носят имя Менделеева. Естественно, что периодическая система элементов за последующие годы получила дальнейшее развитие. Было, как уже говорилось, установлено, что основной величиной для каждого элемента системы Менделеева является порядковый номер, значение которого есть электрический заряд ядра атома элемента. Имя Д. И. Менделеева вошло в историю науки.
Л. Полинг и П. Полинг в книге «Химия» пишут: «Химию можно рассматривать в двух аспектах, выделяя описательную химию - открытие химических фактов и их описание - и теоретическую химию - разработку теорий, позволяющих после проверки установленных фактов обобщить их и представить в виде определенной системы (Широчайшую научную область, охватываемую химией, можно подразделить иначе. Важным представляется деление па органическую и неорганическую химию. Органическая химия - химия соединений углерода, в частности таких, которые входят в состав тканей растений и животных. Неорганическая химия - химия соединений всех остальных элементов, кроме углерода. Каждое из этих направлений химии является частично описательным, частично теоретическим. Многие другие разделы химии, которые, в общем, являются частями органической или неорганической химии, также получили свои названия; таковы аналитическая химия, физическая химия, биохимия, ядерная химия, промышленная химия (химическая - технология) и т. д. Их содержание ясно из самих названий.- Примеч. Л. Полита и П. Полита.).
Нельзя глубоко постигнуть химию, просто изучив химические теории. Даже если студент выучит все известные теории, он не будет знать эту науку, поскольку большая часть химии (многие специфические свойства отдельных веществ) пока еще полностью не обобщена химическими теориями» (Полинг Л., Полинг П. Химия, с. 11).
Следуя путем, указанным Л. Полингом и П. По-лингом, мы приведем несколько примеров как теоретического, так и практического развития химии.
В 1840 г. известным химиком, жившим и работавшим в России, Германом Ивановичем Гессом (1802 - 1850) был открыт закон, носящий теперь его имя. Закон Гесса - основной закон термохимии - может быть сформулирован так: тепловой эффект химических реакций при отсутствии работы внешних сил определяется только начальным и конечным составом участвовавших в реакции веществ и но зависит от «пути следования» химического процесса.
К сказанному необходимо дать некоторые пояснения. Во-первых, при прохождении химических реакций либо выделяется, либо поглощается тепло. Реакции, протекающие с выделением тепла, называются экзотермическими. К ним относятся, в частности, реакции сжигания любого органического топлива: продуктов переработки нефти, природного или промышленного газа, угля, сланцев, дров и т. д. Собственно, именно ради получения тепла топливо и сжигается. Реакции, протекающие с поглощением тепла, называются эндотермическими. Во-вторых, из закона Гесса следует, что если бы мы провели кольцевую реакцию, т. е. в результате ряда химических превращений мы в конце концов получили бы исходные вещества, то суммарный тепловой эффект оказался бы равным нулю. В-третьих, если бы в реакции участвовало вещество, влияющее па скорость протекания реакции (катализаторы, увеличивающие скорость реакции, или ингибиторы, уменьшающие скорость реакции), то на суммарный тепловой эффект это не повлияло бы, так как катализаторы и ингибиторы, по крайней мере теоретически, в конце концов в реакции не участвуют.
В качестве второго примера возьмем закон действующих масс, установленный в 1864 - 1867 гг. норвежскими учеными К. Т. Гульдбергом (1836-1902) и П. Вааге (1833 - 1900). Закон действующих масс может быть сформулирован так: скорость химической реакции, протекающей при постоянной температуре, пропорциональна концентрациям исходных веществ в степенях, равных их стехиометрическим числам, и обратно пропорциональна концентрациям продуктов реакции в степенях, равных их сте-хиометрическим числам.
Если рассматривать химическую реакцию
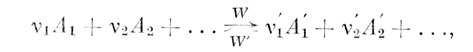
где A1, А2, ...- исходные вещества, v1, v2 и т. д.- их стехиометрические числа, А1, А2 и т. д. - продукты реакции, v1, v2 и т. д.- их стехиометрические числа, W - скорость протекания реакции слева направо, W - справа палево, то видно, что реакция имеет динамический характер: она всегда течет в обоих направлениях. Скорости W и W становятся равными тогда, когда устанавливается химическое равновесие, т. е. состав реагирующей смеси остается неизменным. Но даже и в этом случае реакция продолжает протекать, но таким образом, что состав реагирующей смеси остается постоянным, т. е. достигается химическое равновесие. Величина
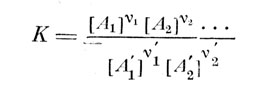
называется константой равновесия ([А1], [А2] и т. д. означают концентрации соответствующих веществ).. Ее значение для данной реакции определяется составом реагентов и параметрами состояния, особенно температурой. Не следует думать, что химическое равновесие устанавливается приблизительно «в середине», при более или менее равном количестве всех реагентов. Наоборот, в большинстве случаев реакция сильно «сдвинута» в одну из сторон. Закон действующих масс имеет большое значение для практики.
Приведем теперь примеры достижений химии в практике. Здесь такой большой выбор, что трудно решить, на чем остановиться.
Большие успехи достигнуты, особенно за последние десятилетия, в органической химии. Очень много сделано в области полимеров, представляющих собой основу для получения пластических масс, синтетических волокон, каучука и других очень нужных материалов.
Известный советский ученый физик и химик Николай Николаевич Семенов (р. 1896) пишет о том, что представляют собой полимеры, так: «Полимеры - это гигантские химические молекулы, образуемые в результате последовательного химического присоединения друг к другу тысяч и десятков тысяч простых молекул, так называемых мономеров. В вытянутом состоянии такого рода гигантские молекулы представляют собой как бы гибкие нити, поперечники которых равны поперечнику мономера, а протяженность их в тысячи раз превосходит длину мономера. Звенья полимерной цепи связаны между собой очень прочными химическими силами. Поэтому полимерные материалы оказываются исключительно прочными. Максимальная прочность их реализуется в том случае, когда все нити располагаются параллельно друг другу, обеспечивая равномерное распределение нагрузки. Одним из важнейших свойств полимеров является возможность легкой реализации их максимальной прочности путем вытягивания материала в нити, как это делается, например, в производстве искусственного волокна.
Данные молекулы полимеров связаны между собой силами притяжения, которые тем больше, чем больше длина молекулы. По этой причине полимеры являются твердыми прочными телами, в то время как мономеры представляют собой при обычных температурах газы или жидкости» (Семенов И. Н. Наука и общество. М., 1973, с. 45.)
Огромное развитие химии, именуемое иногда химизацией народного хозяйства, нашло свое выражение в быстром росте полимерной промышленности, продукция (полимерные материалы) которой находит широкое применение в машиностроении в качестве конструкционных материалов, успешно заменяющих (в пределах известных ограничений, конечно, например высокой температуры) сталь и цветные металлы; в ускоренном развитии промышленности, производящей минеральные удобрения и другие нужные сельскому хозяйству продукты; в строительстве, где полимерные материалы успешно используются как строительные материалы; в изготовлении одежды (особенно в виде волокон) и еще для многих других изделий. Этот перечень развития различных направлений химической промышленности можно было бы продолжить.
|
ПОИСК:
|
© NPLIT.RU, 2001-2021
При использовании материалов сайта активная ссылка обязательна:
http://nplit.ru/ 'Библиотека юного исследователя'
При использовании материалов сайта активная ссылка обязательна:
http://nplit.ru/ 'Библиотека юного исследователя'