
СТРОЕНИЕ ВЕЩЕСТВА. КВАНТОВАЯ ТЕОРИЯ
Первые попытки представить себе, как устроено вещество (какова его структура, из каких «кирпичиков» оно состоит), отделены от нашего времени многими столетиями. Сейчас трудно сказать, кто первый произнес слово «атом»; возможно, это был древнегреческий мыслитель Демокрит, живший в V - IV вв, до н. э.
Как начало современной науки относят к XV - XVII вв., так началом атомной физики - науки, в задачи которой входит изучение строения и «жизни» атомов, - считают конец XIX - начало XX в.
Очень давно было установлено, что атомы очень малы, что невозможно их увидеть даже в любой самый сильный микроскоп. Однако посредством опыта английского физика Чарльза Вильсона (1869 - 1959) в 1912 г. было установлено, что в среде пересыщенного водяного пара вдоль движения заряженной частицы в результата конденсации пара возникает след (трек), состоящий из мелких капелек жидкости. Так можно было убедиться з существовании атомов. В настоящее время созданы специальные весьма совершенные устройства (пузырьковые камеры), позволяющие фиксировать следы микрочастиц.
Сначала считали, что атом представляет собой индивидуальную частицу вещества, свойства которой являются необъяснимыми. В 1869 г. великий русский химик Дмитрий Иванович Менделеев (1834 - 1907) открыл периодический закон химических элементов, согласно которому с увеличением атомной массы элементов их химические и физические свойства периодически повторяются, Менделеевым была составлена периодическая система элементов, которой в дальнейшем было присвоено его имя.
Атомная физика как самостоятельная наука возникла па основе открытия электрона и радиоактивного излучения. Электрон - отрицательно заряженная микрочастица с массой всего лишь около 9 10-28 г, один из основных структурных элементов вещества, был открыт известным английским физиком Джозефом Джоном, Томсоном (1858 - 1940), членом (с 1884 г.) и президентом (1915 - 1920 гг.) Лондонского королевского общества, иностранным почетным членом Академии наук СССР. Оказалось, что так называемые катодные лучи, испускаемые катодом и проходящие через сильно разреженные газы, представляют собой поток электронов. Изучение катодных лучей привело к выводу, что электроны входят в состав всех атомов. На рис. 42 показан простейший опыт по фотоэлектрическому эффекту: свет, падающий па пластинку, вызывает испускание электронов, пластинка заряжается, что видно по разошедшимся листочкам электроскопа.
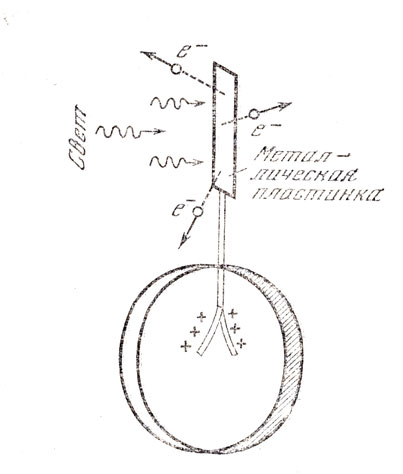
Рис. 42. Фотоэлектрическим эффект
Поскольку электроны имеют отрицательный заряд, а атом в целом электрически нейтрален, было нетрудно заключить, что атом должен иметь в своем составе и положительно заряженные частицы.
В 1896 г. французским физиком Антуаном Анри Беккерелем (1852 - 1908) впервые была обнаружена радиоактивность (от лат. radio - испускаю лучи и activus - действенный) солей урана. Явление радиоактивности, окончательно опровергнувшее представление о неделимости (о непревращаемости) атома, заключается в самопроизвольным превращении неустойчивых ядер атомов (о ядрах атомов будет сказано через несколько строк) и ядра других элементов (других атомов), происходящем в результате ядерных излучений. Оказалось также (это было чрезвычайно важно для медицины), что лучи, открытые Беккерелем, могли проникать в глубь вещества и поэтому являлись средством получения фотографий, например, внутренних органов человека.
Вопросы радиоактивности различных элементов изучались французскими физиками Пьером Кюри (1859 - 1906) и его супругой, Марией Склодовской-Кюри (1867 - 1934). Ими были открыты (1898 г.) новые элементы полоний и радий. Было установлено, что радиоактивное излучение может быть двух видов: либо ядро радиоактивного элемента испускает а-частицу (ядро атома гелия с положительным зарядом 2е), либо β-частицу (электрон с отрицательным зарядом - е). В обоих случаях атом радиоактивного элемента превращается в атом другого элемента, например в атом свинца или висмута (это зависит как от исходного радиоактивного вещества, так и от вида радиоактивного излучения).
Следует еще раз отметить, какое огромное значение для развития науки (а также для практики) имело открытие радиоактивности. Вспомним, что один из величайших химиков за всю историю науки - Лавуазье установил во второй половине XVIII в. закон неизменности элементов, опроверг стремления и надежды алхимиков получать одни химические элементы (прежде всего, конечно, золото) из других. И вдруг оказалось, что в результате радиоактивного излучения некоторые элементы превращаются - да еще самопроизвольно - в другие. Это ли не научная сенсация?
Конечно, с течением времени, кстати довольно короткого, явление радиоактивности и превращение одних (радиоактивных) элементов в другие (например, нерадиоактивные) нашло свое объяснение.
В исследованиях радиоактивности большое значение имели совместные работы знаменитого английского фн ка Эрнеста Резерфорда (1871 - 1937) и известного aнлийского химика Фредерика Содди (1877 - 1956), проведенные в 1899 - 1907 гг. В качестве исходных радиоактивных элементов ими использовались уран, торий и актиний. Были обнаружены так называемые изотопы, т. е. разновидности одного и того же химического элемента, имеющие одинаковые химические свойства и занимающие одно и то же место в периодической системе элементов Менделеева, но отличающиеся массой атомов.
Одна из первых моделей атома была предложена в 1903 г., уже знакомым нам Дж. Дж. Томсоиом. Ею модель (рис. 43) представляла собой положительно заряженную сферу с вкрапленными в нее отрицательно заряженными электронами. Сохранение электроном определенного места в сфере есть результат, но Дж. Дж. Томсону, равновесия между положительным распределенным зарядом сферы и отрицательными зарядами электронов.

Рис. 43. Модель атома Дж. Дж. Томсона
Но модель атома Дж. Дж. Томсона просуществовала сравнительно недолго. Опыты, начатые в 1907 Г. Э. Резерфордом и его помощниками, в том числе немецким физиком Хансом Гейгером (1882 - 1945), дали результаты, которые не могли быть объяснены с помощью модели Дж. Дж. Томсона.
Прежде чем рассказывать об этих интереснейших опытах, скажем несколько слов о жизни и деятельности Эрнеста Резерфорда, так много сделавшего для развития атомной физики. Резерфорд, член Лондонского королевского общества, почетный член Академии наук СССР, родился в 1871 г. в Новой Зеландии, в семье мелкого фермера, четвертым из 12 детей. Окончил Новозеландский университет (г. Крайстчерч). 13 1894 г. переехал в Англию и был принят в Кавендишскую лабораторию Кембриджского университета, где начал вести исследования под руководством Дж. Дж. Томсона. Большую часть жизни (с некоторыми перерывами во время работы в Монреальском и Манчестерском университетах) Резерфорд провел в Кембридже, будучи с 1919 г. директором Кавеы-дишской лаборатории. Он воспитал большое число высококвалифицированных физиков.
Опыты Резерфорда, показавшие неприемлемость модели атома Дж. Дж. Томсона, заключались в следующем, имеющие высокую скорость а-частицы направлялись на тонкий слой вещества (например, фольгу). Эффект получался двух родов: подавляющее большинство а-частиц только немного изменяло свою траекторию - под влиянием электрического поля атомов вещества происходило рассеяние ос-частиц; небольшое число ос-частиц, наоборот, как бы встретившись с непреодолимым препятствием, резко (более чем на 90°) изменяло направление своего полета.
Все эти опыты были проделаны с большой виртуозностью. Были разработаны методы сцинтилляций (возбуждение заряженными частицами в некоторых веществах световых вспышек - сцинтилляций - и их регистрация) и газоразрядных счетчиков.
На основании этих опытов Резерфорд пришел к выводу, что в атомах существуют ядра- положительно заряженные микрочастицы, размер которых (приблизительно 10-12 см) очень мал по сравнению с размерами атомов (около 10-8 см), но масса атома почти полностью сосредоточена в его ядре. Таким образом, а-частица резко изменяет направление своего пути, когда наталкивается на ядро.
Открытие ядер атомов было очень крупным событием в развитии атомной физики. Вот что пишет по этому поводу один из наиболее известных физиков - Нидьс Бор: «В текущем столетии изучение вновь открытых свойств материи, таких, как естественная радиоактивность, убедительно подтвердило основы атомной теории. В частности, благодаря развитию усилительных свойств стало возможным изучать явления, существенно зависящие от отдельных атомов, и даже удалось получить обширные сведения о структуре атомных систем. Первым шагом было признание того, что электрон является общей составной частью всех веществ; дальнейшим шагом, существенно дополнившим наши представления о строении атома, было открытие Резерфордом атомного ядра, где в чрезвычайно малом объеме сосредоточена почти вся масса атома. Неизменяемость свойств элементов при обычных физических и химических процессах непосредственно объясняется тем, что в таких процессах, хотя связи электронов и могут сильно меняться, ядро остается без изменений. Резерфордом была доказана и взаимная превращаемость атомных ядер под действием более мощных сил. Тем самым Резерфорд открыл совершенно новую область исследований, которую часто называют современной алхимией. Как хорошо известно, эти исследования должны были в конечном счете привести к возможности освобождать огромные количества энергии, запасенные в атомных ядрах» (Бор Н. Атомная физика и человеческое познание. М., 1961 с. 99 - 100.) .
Установив существование атомных ядер, Резерфорд предложил в 1911 г. свою модель атома, которая получила название планетарной модели атома Резерфорда. Действительно, новая модель атома напоминает Солнечную систему: в центре находится атомное ядро, а вокруг ьпо по своим орбитам движутся лeктpoны. Ядро имеет положительный заряд, а электроны - отрицатслынный. Вместо сил тяготения, действующих в Солнечной системе, в атоме действуют электрические силы Электрический ядра атома, численно равный порядковому номеру в периодической системе Менделеева, уравновешивается суммой зарядов электронов - атом электрически нейтрален.
Но планетарная модель атома Резерфорда также имела свои неразрешимые противоречия. Дело заключается в следующем. Электроны обязательно должны двигаться вокруг ядра, в противном случае они потеряли бы устойчивость. В то же время, согласно законам электродинамики, любое тело (частица), имеющее электрический заряд и движущееся с ускорением, обязательно должно излучать электромагнитную энергию. Но в этом случае электроны очень быстро потеряли бы свою кинетическую энергию и упали на ядро.
Есть и еще одно противоречие. В соответствии с законами электродинамики частота излучаемой электроном электромагнитной энергии должна быть равна частоте собственных колебаний электрона в атоме или (что тоже) числу оборотов электрона вокруг ядра в секунду. Но в этом случае спектр излучения электрона должен быть непрерывным, так как электрон, приближаясь к ядру, менял бы свою частоту. Опыт же показывает другое: атомы излучают свет только определенных частот. Именно поэтому атомные спектры называются линейчатыми (рис. 44) . Другими словами, планетарная модель Резерфорда оказалась несовместимой с электродинамикой Максвелла.
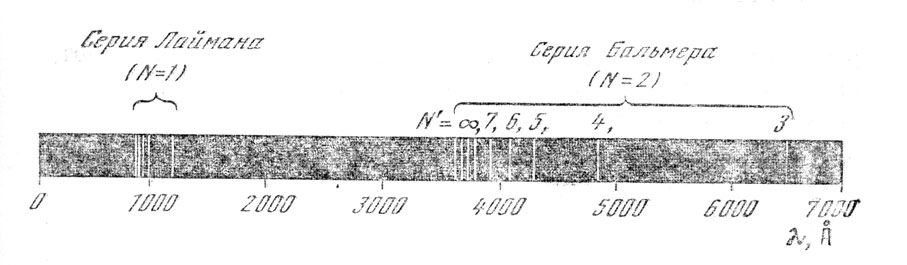
Рис. 44. Линейчатый спектр водорода
Следующая, предложенная Бором модель атома была основана на квантовой теории. Один из крупнейших физиков XX в. - датчанин Нильс Бор (1885 - 1962) родился и окончил университет в Копенгагене. Работал в Кембриджском университете под руководством Дж. Дж. Томсона и в Манчестерском университете под руководством Резерфорда. В 1916 г. был избран заведующим кафедрой теоретической физики Копенгагенского университета, с 1920 г. и до конца жизни руководил созданным им в Копенгагене Институтом теоретической физики, который теперь носит его имя. В 1943 г., во время оккупации Дании гитлеровцами, Бор, видя, что над ним готовится расправа, с помощью организации Сопротивления перебрался на лодке в Швецию, а затем переехал в США. После окончания войны он возвратился в Копенгаген.
Созданная Бором модель атома основывалась на планетарной модели атома Резерфорда и на разработанной им самим в 1913 г. квантовой теории строения атома. Бором были сформулированы два постулата, совершенно несовместимые с классической физикой:
1) в каждом атоме существует несколько стационарных состояний (говоря языком планетарной модели, несколько стационарных орбит) электронов, двигаясь по которым (на которых) электрон может существовать, не излучая (Напомним, что, согласно классической физике, движение заряженного электрона по траектории, отличной от прямом линии, сопровождается излучением. );
2) при переходе электрона из одного стационарного состояния в другое электрон (атом) излучает или поглощает порцию энергии:
ΔЕ=hv=E1-E 2
где v, с-1 частота излучаемой или поглощаемой электромагнитной энергии (Согласно классической физике, частота излучения связана с количеством излучаемой энергии.); h=6,62 х 10-27 эрг с - постоянная Планка.
Из постулатов Бора следует, что предложенная им в 1913 г. модель атома являлась как бы «дополненной и исправленной» планетарной моделью. Действительно, понятными стали линейчатые спектры атомов: каждой линии спектра соответствует переход электрона из одного стационарного состояния в другое. На рис. 45 представлены энергетические уровни атома водорода, изображенные горизонтальными линиями. Частоты переходов представлены вертикальными линиями, длина которых пропорциональна частоте. Буквы W1, W2, W3 и т. д. обозначают энергию стационарных уровней атома водорода: N1, N2, N3 и т. д. - квантовые числа.
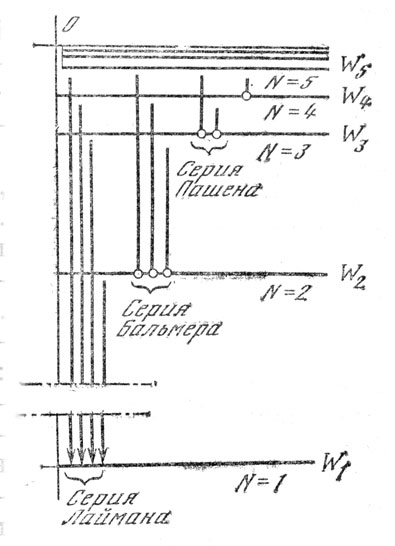
Рис. 45. Стационарные уровни энергии атома водорода и частоты спектров (переходов)
Постулаты Бора объясняют устойчивость электронов: находящиеся в стационарных состояниях электроны без внешней на то причины не излучают электромагнитной энергии. Было также установлено, что переход электрона на более далекую от ядра орбиту приводит к увеличению энергии атома и, наоборот, переход электрона на орбиту, более близкую к ядру, вызывает уменьшение энергии атома.
Следует отметить, что модель, предложенная Бором, была встречена с явным недоверием. Этому способствовала ее кажущаяся внутренняя противоречивость. Действительно, орбиты электронов, по Бору, вычислялись на основе законов классической физики, но только некоторые из них, подчиняющиеся дополнительному, ничем не обоснованному правилу, считались реальными. Далее, вопреки классической физике, принималось, что электроны, двигаясь по этим избранным орбитам, не излучают; постулировалось, что элементарный акт излучения происходит при «перескоке» электрона с одной орбиты на другую.
Решающим доводом в пользу теории Бора явилось ее сопоставление с экспериментальными данными. Опираясь на постулаты своей теории, Бор вычислил частоты всех спектральных линий атома водорода. Вычисленные и измеренные частоты совпали с очень высокой точностью. В дальнейшем на основе теории Бора удалось объяснить и некоторые другие особенности спектральных наблюдений.
Вместе с тем теория Бора натолкнулась на непреодолимые трудности. Так, например, на основе теории Бора оказалось невозможным объяснить, почему в спектре атома водорода одни линии яркие, в то время как другие слабые. Не смогла объяснить теория Бора и спектры атомов более сложных, чем водород, у которых имеется несколько электронов.
Создавалось впечатление, что постулаты Бора отражают какие-то новые, неизвестные свойства материи, но лишь частично. Ответы на эти вопросы были получены в результате развития квантовой механики, о которой речь пойдет ниже.
В 1924 г. произошло одно из величайших событий в истории физики: французский физик Луи де Бройль (р. 1892) выдвинул идею о волновых свойствах материи, положив тем самым начало квантовой механике. Он утверждал, что волновые свойства наряду с корпускулярными присущи всем видам материи: электронам, протонам, атомам, молекулам и даже макроскопическим телам.
Согласно де Бройлю, любому телу массой m, движущемуся со скоростью v, соответствует волна
Фактически аналогичная формула была известна раньше, но только применительно к частицам света - фотонам. Как было сказано выше, энергия фотона E=hv. Согласно Эйнштейну, между энергией и массой любого тела существует связь Е =mс2.
Зная также зависимость hv = с, легко получить для фотона λ = h/тс - h/p, где λ - длина волны, h - постоянная Планка, т - масса частицы, с - скорость света, р = тс - импульс.
Гипотеза де Бройля нуждалась в опытном подтверждении. Наиболее убедительным подтверждением существования волновых свойств материи является наблюдение (обнаружение) дифракции электронов, что и было осуществлено в 1927 г. американскими физиками Клинтоном Дэвиссоном (1881 - 1958) и Лестером Джермером (1896 - 1971). Они провели следующий опыт. Пучок электронов, разогнанный в электрическом поле до энергии 100 электронволът (Электроивольт - единица энергии, применяемая для измерения энергии микрочастиц (1 эВ=1,602 10-2 эрг). ), направлялся на кристалл никеля. Электроны отражались от кристалла и летели лишь по некоторым избранным направлениям. Распределение электронов по направлениям оказалось таким же, как если б на кристалл падал пучок света с длиной волны, равной длине волны электронов, вычисленной по формуле де Бройля. Иначе говоря, Дэвиссон и Джермер впервые наблюдали дифракцию электронов и тем самым экспериментально подтвердили гипотезу де Бройля.
В дальнейшем опыты по дифракции электронов проводились на различных кристаллах с электронами разных анергий. Более того, были выполнены опыты по дифракции нейтронов, атомов и даже молекул. Во всех случаях результаты полиостью подтвердили точку зрения де Бройля.
Может все же возникнуть вопрос: почему наблюдается дифракция только микрообъектов и не проявляются волновые свойства макротел? Почему, например, не наблюдается дифракция биллиардной) шара при прохождении лузы?
Дело в том, что длина волны электрона с энергией 100 электронвольт оказывается приблизительно равной 10-8 см. Эта величина сравнима с повторяющимся в кристалле расстоянием между соседними узлами решетки.
В этих условиях дифракционные эффекты легко прояв ляются.
Длина волны биллиардного шара (масса приблизительно 100 г, скорость около 1 м/с) примерно равна 10-30 см. Она настолько меньше ширины лузы, что никакой дифракции быть не может. (По этой же причине не наблюдается дифракция при прохождении видимого света с А, = 5 х 10-5 см через щель в заборе шириной в несколько миллиметров.)
Гипотеза де Бройля, получившая многочисленные экспериментальные подтверждения, превратилась в принципиальную основу, вероятно, наиболее широкой физической теории - квантовой механики.
Дальнейшее развитие этого нового необычайно плодотворного направления было в основном достигнуто в конце 20-х - начале 30-х годов трудами известных физиков: Макса Борна (1882 - 1970), Бернера Гейзенберга (1901 - 1976), Ноля Дирака (р. 1902), Эрвина Шрёдингера (1887 - 1961), а также Вольфганга Паули (1900 - 1958), Эирико Ферма (1901 - 1954), Владимира Александровича Фока (1898 - 1974) и многих других.
Отдельными разделами квантовой механики стали атомная физика, теория излучения, теория строения молекул (которую иногда называют квантовой химией), теория твердого тела, теория взаимодействия элементарных частиц (Об элементарных частицах еще будет сказано.), теория строения атомного ядра и др. Многочисленные и разнообразные эксперименты неизменно подтверждали выводы квантовой механики. Даже такое, можно сказать неожиданное, предсказание квантовой механики, как существование позитрона (так сказать, электрон с положительным зарядом, его называют также античастицей электрона), было подтверждено опытом. Следует сказать, что квантовая механика - более широкая теория по сравнению с классической механикой, которая является частным случаем квантовой механики.
Конечно, квантовая механика отнюдь не является пределом знаний в своей области. Еще раз хотим напомнить читателю, что никакая теория не может закрыть горизонты развития науки. В то же время можно не сомневаться в том, что квантовая механика навсегда сохранится в золотом фонде науки.
В квантовой механике имеется установленное Гейзенбергом так называемое соотношение неопределенностей. Суть дела заключается в следующем. Допустим, ставится задача определить состояние движущегося электрона (или любой другой микрочастицы). Если бы можно было воспользоваться законами, классической механики, то в принципе все было бы очень просто. Надо было бы определить его местоположение и импульс (количество движения). Но законы классической механики, как следует из всего сказанного ранее, для микрочастиц применяться не могут. Необходимо использовать законы квантовой механики. Вот тут-то и приходится встретиться с соотношением неопределенностей. Математическое выражение соотношения неопределенностей очень простое:
ΔхΔp≥h
где Δх - неточность в определении координаты электрона; Δр - неточность в определении импульса электрона; h - постоянная Планка.
Из этого выражения видно, что невозможно одновременно определить положение электрона в пространстве и его импульс. Действительно, если Δx очень мало, т. е. положение электрона в пространстве известно с большой степенью точности, то Δр относительно велико и, следовательно, величина импульса может быть вычислена с такой малой степенью точности, что практически ее приходится рассматривать как величину неизвестную. И наоборот, если мало Δр и поэтому импульс электрона известен, то велико х и, следовательно, неизвестно положение электрона в пространстве. Разумеется, принцип неопределенности справедлив для любой частицы, а не только для электрона.
С точки зрения классической механики принцип неопределенности представляется абсурдным. С позиций «здравого смысла» он кажется по крайней мере очень странным: никак нельзя представить себе, как все это может быть «на самом деле».
Чтобы лучше оценить создавшееся положение, не надо забывать, что все мы, люди, живем в макромире, в мире больших тел, которые мы видим своими глазами (хотя бы с помощью микроскопа) и можем измерить их размеры, массу, скорость передвижения и многое другое. Наоборот, микромир для нас невидим, мы не можем непосредственно измерить ни размеры электрона, ни его энергию. Чтобы лучше представить себе явления микромира, нам всегда хочется построить адекватную механическую модель, и это иногда удавалось сделать. Вспомните, например, планетарную модель атома Резерфорда. Она в известной мере похожа на Солнечную систему, являющуюся для нас в этом случае механической моделью. Поэтому планетарная модель атома воспринимается легко.
Но для большинства объектов и явлений микромира построить механическую модель невозможно, и поэтому положения квантовой механики часто воспринимаются с большим трудом. Действительно, попробуйте, например, построить механическую модель электрона, обладающего корпускулярно-волновыми свойствами, или механическую модель, поясняющую, почему для электрона нельзя одновременно определить его массу и импульс.
Поэтому, когда говорят, как бы лучше представить себе электрон, имеющий корпускулярно-волиовые свойства, обычно сознательно или бессознательно имеют в виду построение механической модели. А построить ее невозможно. Именно поэтому лучше сделать в этих случаях акцент на «понять», а не на «представить».
Хорошо сказал по этому поводу один из крупнейших советских физиков - Лев Давидович Ландау (1908 - 1968): «Величайшим достижением человеческого гения является то, что человек может понять вещи, которые он уже не в силах вообразить» (Цит. по: Слово с науке / Сост. Е. С. Лихтенштейн. М., 1981, кн. 2, с. 56.).
Л знаменитый американский физик-теоретик Ричард Фейпман (р. 1918) писал: «Раз поведение атомов так не похоже па наш обыденный опыт, то к нему очень трудно привыкнуть. И новичку в науке, и опытному физику всем оно кажется своеобразным и туманным. Даже большие ученые не понимают его настолько, как им хотелось бы, и это совершенно естественно, потому что весь непосредственный опыт человека, вся его интуиция - все прилагается к крупным телам. Мы знаем, что будет с большим предметом; но именно так мельчайшие тельца не поступают. Поэтому, изучая их, приходится прибегать к различного рода абстракциям, напрягать воображение и не пытаться связывать их с нашим непосредственным опытом» (Цит. по: Савельев II. В. Курс общей физики. 2-е изд. М.: Наука, 1982, т. 3, с. 65 - 66.)
Хотим добавить к сказанному, что принцип неопределенности (соотношение неопределенностей) является фундаментальным положением квантовой механики.
Основным уравнением квантовой механики является уравнение, сформулированное Шрёдингером в 1926 г. Необходимо отметить, что уравнение Шрёдингера не может быть выведено из каких-либо других соотношений. Шрёдингером была введена специальная волновая функция координат и временя, характеризующая состояние микрочастиц.
В книге «О природе материи» известный советский физик М. А. Марков пишет: «Если найдена адекватная физическим идеям математическая форма, то дальше математический аппарат в общем действует «автоматически», автоматически получаются все следствия, которые вытекают из данных представлений о предмете обсуждения, положенных в основу наших математических уравнений.
Но главное, математический аппарат, адекватный физическим идеям, предохраняет от применения макроскопических аналогий там, где они ужо теряют свой смысл, т. е. от ошибки наглядных представлений, о которых неоднократно шла речь выше. Очень существенно, что этот же аппарат автоматически дает количественную «оценку» критерия применимости того или иного макроскопического понятия» (Марков М. А. О природе материи. М., 1976, с. 35 - 36..) Вот именно: Шрёдингеру удалось составить уравнение, которое оказалось адекватным идеям квантовой механики.
Один из основоположников квантовой механики - швейцарский физик-теоретик Паули установил в 1925 т. имеющий большое значение принцип (носящий теперь название принципа Паули), являющийся фундаментальным законом. Согласно этому принципу, ни в атоме, ни в молекуле не может быть двух электронов, находящихся в одинаковом состоянии. Например, в атоме на одной орбите (если пользоваться представлениями Резерфорда) могут находиться только два электрона; по тогда их спины должны быть направлены в разные стороны, и их состояния поэтому различны. Принцип Паули помог определить число различных электронных состояний в электронной оболочке атома (число орбит).
Термин элементарные частицы, к рассмотрению которых мы теперь переходим, первоначально означал простейшие частицы, из которых состоят атомы вещества.
Известный английский физик, ученик Резерфорда Джеймс Чедвик (1891 - 1974) открыл нейтрон - нейтральную частицу, входящую вместе с протонами в ядро атома и сыгравшую такую важную роль в создании способов использования ядерной энергии.
После открытия электрона, протона, фотона и, наконец, в 1932 г. нейтрона было установлено существование большого числа новых элементарных частиц - в общей сложности около 350. В том числе: позитрон, о котором мы уже упоминали как об античастице электрона; мезоны - нестабильные микрочастицы (к ним относятся (I - мезоны, - мезоны и более тяжелые - мезоны) ; различного вида гипероны - нестабильные микрочастицы с массами больше массы нейтрона; частицы-резонансы, имеющие крайне короткое время жизни (порядка 10-22-10-24 с); нейтрино - стабильная, не имеющая электрического заряда частица, по-видимому, с пулевой массой покоя, обладающая почти невероятной проницаемостью; антинейтрино - античастица нейтрино, отличающаяся от нейтрино знаком лептонного заряда, и др.
В этой книге нет возможности говорить о свойствах и особенностях отдельных элементарных частиц, да, пожалуй, это и не отвечало бы ее назначению. Но зато необходимо сказать о некоторых более общих понятиях, касающихся элементарных частиц. Вполне уместен, в частности, вопрос: какими свойствами элементарных частиц пользуются, различая их между собой? Некоторые из этих свойств вполне привычны: масса, электрический заряд, время жизни; другие - менее привычны: спин, т. е. собственный момент количества движения микрочастицы, имеющий квантовую природу и не связанный с движением частицы как целого, измеряется в единицах постоянной Планка h(h=h/2π) и может быть целым или полуцелым (1/2, 3/2 ...) числом; квантовые числа (также целые или полуцелые), характеризующие состояние элементарных частиц.
В характеристике элементарных частиц существует еще одно важное представление - взаимодействие. Различают четыре вида взаимодействия. Сильное взаимодействие (короткодействующее, радиус действия приблизительно 10-13 см), связывающее между собой нуклоны (протоны и нейтроны) в ядре; именно по этой причине ядра атомов являются весьма устойчивыми, их трудно разрушить.
Электромагнитное взаимодействие (дальнодействугющее, радиус действия но ограничен, поскольку силы взаимодействия медленно убывают с расстоянием) определяет взаимодействие между электронами и ядрами атомов или молекул; взаимодействующие частицы имеют электрические заряды; этот вид взаимодействия проявляется в таких макроскопических явлениях, как химические связи, упругость, трение; переносчиком этого вида взаимодействия между частицами является электромагнитное поле.
Слабое взаимодействие (короткодействующее, радиус действия меньше 10-15 см), в котором участвуют все элементарные частицы, обусловливает взаимодействие нейтрино с веществом.
Гравитационное взаимодействие - самое слабое взаимодействие, не учитываемое в теории элементарных частиц; распространяется на все виды материи. Наоборот, когда речь идет об очень больших массах, гравитационное взаимодействие (тяготение) имеет решающее значение. Радиус действия не ограничен.
Элементарные частицы обычно разделяют на следующие классы:
1) фотоны - кванты электромагнитного поля, частицы, как уже говорилось, с нулевой массой покоят, не имеют сильного и слабого взаимодействия, но участвуют в электромагнитном взаимодействии;
2) лептоны (от греч. leptos - легкий), к числу которых относятся электроны, нейтрино; все они не обладают сильным взаимодействием, но участвуют в слабом взаимодействии, а имеющие электрический заряд - также и в электромагнитном взаимодействии;
3) мезоны - сильно взаимодействующие нестабильные, как уже говорилось, частицы, могущие участвовать также и в слабом взаимодействии, а при наличии электрического заряда - и в электромагнитном;
4) барионы (от греч. barys - тяжелый), в состав которых входят нуклоны (т. е. протоны и нейтроны), нестабильные частицы с массами, большими массы нейтрона, гипероны, многие из резонансов.
Сначала, особенно когда число известных элементарных частиц ограничивалось электроном, протоном и нейтроном, господствовала точка зрения, что атом состоит из этих элементарных «кирпичиков». А дальнейшая задача в исследовании структуры вещества заключается в том, чтобы разыскивать новые, еще неизвестные «кирпичики, из которых состоит атом, и в определении того, не являются ли эти «кирпичики» (или некоторые из них) сами сложными частицами, построенными из еще более тонких «кирпичиков».
При таком подходе к делу было логично считать элементарными только те частицы, которые не могут быть разделены на более мелкие или которые мы пока не можем разделить. Смотря так на структуру материи, молекулу и атом нельзя было бы считать элементарными частицами, так как молекула состоит из атомов, а атомы - из электронов, протонов и нейтронов.
Однако действительная картина строения вещества (или, лучше сказать, картина, которую мы сегодня считаем действительной) оказалась еще более сложной, чем можно было предполагать. Оказалось, что элементарные частицы могут претерпевать взаимные превращения, в результате которых некоторые из них исчезают, а некоторые появляются. Например, в результате столкновения двух протонов образуются протон, нейтрон и я+-мезон, а при столкновении электрона и позитрона (процесс аннигиляции) возникают два фотона. Нестабильные микрочастицы распадаются на другие, более стабильные, но это вовсе не значит, что первые состоят из вторых.
Поэтому в настоящее время под элементарными частицами понимают такие «кирпичики» Вселенной, из которых можно построить все, что нам известно в ириродз. Мир элементарных частиц сложен, а теория элементарных частиц находится в начале своего развития. Вероятно, ближайшие годы внесут в нее много нового. О трудности решения задач подобного рода Эйнштейн и Инфельд говорят следующее: «Физические понятия суть свободные творения человеческого разума и неоднозначно определены внешним миром, как это иногда может показаться. В нашем стремлении понять реальность мы отчасти подобны человеку, который хочет понять механизм закрытых часов. Он видит циферблат и движущиеся стрелки, даже слышит тиканье, но он не имеет средств открыть их корпус. Если он остроумен, он может нарисовать себе некую картину механизма, которая отвечала бы всему, что он наблюдает, но он никогда не может быть вполне уверен в том, что его картина единственная, которая могла бы объяснить его наблюдения. Он никогда не будет в состоянии сравнить свою картину с реальным механизмом, и он не может даже представить себе возможность или смысл такого сравнения. Но он, конечно, уверен в том, что по мере того, как возрастает его знание, его картина реальности становится все проще и проще и будет объяснять все более широкий ряд его чувственных восприятий» (Эйнштейн А., Инфельд Л. Эволюция физики, с. 30.)
Приблизительно в 1963-1964 гг. появилась гипотеза о существовании кварков - частиц, из которых состоят все барионы и мезоны, являющиеся сильно взаимодействующими и по этому свойству объединенными общим названием адронов. Ужо около двадцати лет прошло с тех пор, как была выдвинута гипотеза кварков, но до настоящего времени вопрос о их существовании нельзя считать решенным. Однако большинство физиков, по-видимому, полагает, что кварки существуют. Кварки (если они существуют) имеют весьма необычные свойства: они обладают дробными электрическими зарядами, что не характерно какой-либо другой микрочастице, и, по-видимому, не могут существовать в свободном, не связанном виде. Число различных кварков, отличающихся друг от друга величиной и знаком электрического заряда и некоторыми другими признаками, достигает уже 36, если не больше.
Приводим интересное соображение известного советского физика В. Л. Гинзбурга, непосредственно касающееся кварков: «Нужно ли, впрочем, решать вопрос в какой-то категорической форме: «адроны состоят из кварков» или «кварки - это лишь вспомогательное понятие»? Не является ли более привлекательной картина, в которой адроны представляют собой сложные динамические системы, имеющие общие черты с атомами и атомными ядрами, но качественно отличные от них именно в смысле их неделимости на самостоятельные составные части? Такой подход кажется весьма глубоким (Воспользуемся случаем, чтобы привести здесь приписываемое Н. Бору определение глубокого утверждения или замечания: «Для того чтобы определить, которое утверждение является глубоким, нужно раньше определить, что такое ясное утверждение. Утверждение считается ясным, если противоположное утверждение или правильно, или ложно. Глубокое утверждение должно обладать тем свойством, что противоположное утверждение также является глубоким».- Примеч. В. Л. Гинзбурга. ). Все развитие атомистики шло по пути введения все новых первичных кирпичей вещества (молекулы, атомы, атомные ядра и электроны, нуклоны); кварки были бы еще одним этапом на этом пути, и если так продолжать, то встал бы вопрос: а из чего состоят кварки? Более того, протокварки уже фигурируют в физической литературе. Но не все могут верить в существование «бесконечной матрешки» - открыли одну куклу, а в ней лежит другая, и так без конца. Глубокой и вместе с тем естественной по ряду соображений представляется мысль как раз о том, что безграничное и механическое повторение процесса деления вещества когда-то прекращается, причем нетривиальным образом: бариоыы и мезоны, возможно, одновременно и состоят из частей (типа каких-то кварков) и не состоят из них. Именно так можно описать ситуацию, в которой составные части не могут существовать сами по себе (в свободном состоянии), но тем не менее в ряде отношений ведут себя аналогично ядру в атоме или нуклонам в ядре» (Гинзбург В. Л. О физике и астрофизике, с. 63 - 64.)
В заключение настоящего раздела необходимо сказать о большом значении для изучения микроструктуры вещества ускорителей заряженных частиц (электронов, протонов, атомных ядер), используемых для получения частиц высоких энергии, с помощью которых удается проследить процессы, происходящие с элементарными частицами. Ускоряемые частицы движутся в вакуумной камере, а управление их движением производится чаще всего с помощью магнитного поля.
|
ПОИСК:
|
© NPLIT.RU, 2001-2021
При использовании материалов сайта активная ссылка обязательна:
http://nplit.ru/ 'Библиотека юного исследователя'
При использовании материалов сайта активная ссылка обязательна:
http://nplit.ru/ 'Библиотека юного исследователя'