
ФОРМАЛЬНАЯ МОДЕЛЬ АТОМА
Популяризация (как и всякая наука) имеет свои границы. Как правило, они определяются тем, что с некоторого момента становится невозможным использовать понятия и образы повседневной жизни. Для того чтобы эту границу преодолеть, нужно перейти на язык формальных понятий науки (для начала хотя бы примитивный). При всех попытках уйти от этого шага неизбежно возникает неосознанное глухое недовольство, а самая суть науки остается скрытой. Наоборот, преодолев минимальные затруднения, вы можете почувствовать силу логических построений науки и оценить красоту их следствий. Как правило, возникающие технические затруднения ничуть не больше тех, с которыми сталкивается любой школьник при изучении химии: довольно быстро он убеждается, что проще (а главное — понятнее) написать формулу Н2О, чем каждый раз говорить: «Молекула, которая состоит из двух атомов водорода и одного атома кислорода».

Молекулы
Нечто похожее на химические формулы принято и в теории спектров, где главное квантовое число п обозначают цифрами: 1, 2, 3,... а орбитальный момент l — буквами, причем ряду чисел О, 1, 2, 3,... соответствует ряд букв s, р, d, f, ... Поэтому символ 3s, например, соответствует уровню энергии с квантовыми числами n = 3, l = 0, а символ Зр — уровню с n = 3, l = 1.
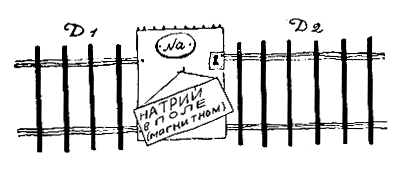
Натрий
В невозбужденном атоме натрия излучающий электрон находится в состоянии 3s. А темная линия D возникает в том случае, если при возбуждении атома электрон переходит в состояние Зр. При обратном переходе Зр -> 3s он излучает энергию и возникает ярко-желтая линия D.
А что произойдет, если излучающий натрий поместить в магнитное поле? Вначале, следуя Зоммерфельду, предполагали, что при этом верхний уровень Зр должен расщепиться на 3 компоненты 2l + 1 = 2•1 + 1 = 3, а нижний останется без изменения. В итоге каждая из линий D1 и D2 должна расщепиться на 3 компоненты.
Опыт противоречит такому заключению. Из рисунка видно, что линия D1 расщепляется на 4 компоненты, а линия D2 — на 6. Это явление — частный случай так называемого аномального эффекта Зеемана. Чтобы понять его причину, необходимо немного возвратиться назад и уяснить себе вопрос, которого мы раньше сознательно избегали: почему даже в отсутствие магнитного поля D-линия натрия состоит из двух тесно расположенных компонент D1 и D2?
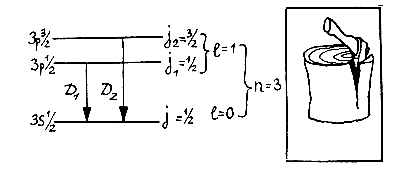
Мучительно размышляя над этим вопросом, ученик Зоммерфельда Вольфганг Паули (1900—1958) пришел в 1924 году к открытию спина электрона (от английского слова spin — веретено). Он рассуждал примерно так: обе линии D1 и D2 соответствуют одному и тому же переходу с уровня n = 3, l = 1 на уровень n = 3, l = 0. Но их все-таки две! Значит, существует не один, а два верхних уровня Зр и еще какое-то дополнительное квантовое число, которое их различает: Свойство, которому соответствует это четвертое квантовое число S, он назвал «неклассической двузначностью электрона» и предположил, что оно может принимать только два значения: +1/2 и —1/2. Паули считал, что наглядное представление этого свойства невозможно.
Открытие спина
Но уже в следующем году Джордж Уленбек (род. 1900) и Сэмюэл Гаудсмит (род. 1902) нашли наглядную модель для объяснения этого свойства электрона, допустив, что он вращается вокруг своей оси. Такая модель прямо следовала из аналогии между атомом и солнечной системой: ведь Земля вращается не только по эллипсу вокруг Солнца, но еще и вокруг своей оси (эту аналогию отмечал и Комптон в 1921, а Крониг — в 1923 году, но Паули резко против нее восстал).
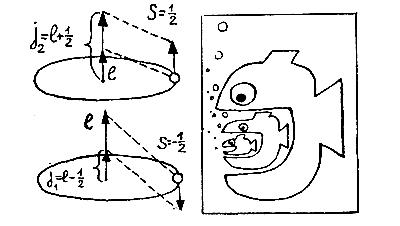
Свойство электрона
Уленбек и Гаудсмит предположили, что, кроме орбитального момента l, значения которого — целые числа и который возникает при движении по эллипсу, электрону присущ внутренний момент вращения, или спин S, равный по величине S = 1/2. Складываясь с орбитальным моментом l, этот внутренний момент S может его увеличить или уменьшить. В результате возникает полный момент j, равный либо j1 = l — 1/2, либо j2 = l + 1/2, в зависимости от взаимной ориентации векторов l и S. Если же l = 0, то полный момент и спин совпадают (j = S = 1/2).
Теперь все встало на свои места: уровень 3s в атоме натрия останется без изменения, так как соответствует моменту l = 0, но уровень Зр расщепится на два: 3 р 1/2 и 3 p3/2 энергии которых немного различны.
В магнитном поле каждый из уровней с полным моментом j (как и в случае момента l) расщепляется еще на (2j + 1) компонент, которые различаются значением магнитного квантового числа m. Таким образом, каждый из уровней 3s1/2 и 3p1/2 расщепится еще на два подуровня, а уровень Зр3/2 — на четыре. В результате возникает та схема уровней и переходов между ними, которая изображена на рисунке (стр. 94) и которая полностью объясняет структуру линий.
Из рисунка видно, как усложнялась первоначальная модель Бора, в которой существовал только один уровень с n = 3. Когда приняли во внимание теорию относительности, он расщепился на два —Зр (n = 3, l=1) и 3s (n = 3, l = 0). С учетом спина электрона уровень Зр расщепляется еще на два подуровня — Зр1/2(n = 3, l = 1, j = 1/2) и 3p 3/2(n = 3, l = 1, j = 3/2). И наконец, в магнитном поле мы получим систему уровней, изображенную на нашем рисунке, которая приводит к картине спектральных линий, наблюдаемых на опыте.
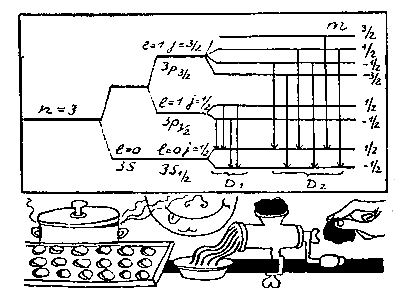
Модель Бора
Гипотеза о спине электрона — одна из самых глубоких в физике. Вполне осмыслить ее значение, не удалось до сих пор. И Паули был, конечно, прав, предостерегая от прямолинейных попыток представлять электрон как вращающийся волчок.
Влияние спина на физические процессы в атоме и на его строение проявляется иногда самым неожиданным образом. Одна из таких особенностей спина составляет содержание знаменитого принципа запрета Паули: в атоме не может быть двух электронов, квантовые числа которых n, I, m, S одинаковы. В дальнейшем мы видим, что только этот принцип позволил найти рациональное объяснение периодической системы элементов Дмитрия Ивановича Менделеева.
Даже по стилю изложения вы, наверное, сейчас заметили, насколько формальная модель атома беднее образами по сравнению с моделью Бора, насколько труднее рассказать о ней привычными словами и представить наглядно. И тем не менее вы, вероятно, ощутили ее силу: на ее основе можно объяснить и предсказать самые тонкие особенности спектров. Устрашающее количество спектральных линий удалось привести в порядок. Теперь, чтобы однозначно определить любую линию в спектре атома, достаточно было задать восемь квантовых чисел: четыре для исходного уровня излучающего электрона (ni, li, mi, Si) и четыре для конечного (nk, lk, mk, Sk).
К 1925 году эта героическая работа была закончена. Иероглифы были расшифрованы, что позволило нарисовать первую и пока грубую картину внутреннего строения атома.
Конечно, расшифровать спектр какого-либо элемента — задача даже сегодня не особенно легкая, и вполне квалифицированно сделать это могут только специалисты. В конце концов научиться читать даже расшифрованные иероглифы не так уж просто, и к тому же не обязательно уметь это делать всем. Но поскольку ключ к шифру известен, то научиться с ним работать может любой.
И теперь уж никого не угнетают длинные таблицы спектральных линий, как не пугают зоологов миллионы видов растений и животных: после трудов Линнея, Ламарка и Дарвина все они подчинены строгой систематике.
Со спектральными линиями произошло то же самое, что и с настоящими египетскими иероглифами: пока их не прочли, они были интересны только египтологам, остальные интересовались ими лишь абстрактно. Но когда иероглифы и спектры расшифровали, одним удалось прочесть историю целого народа, другим — узнать устройство атома. А это уже интересно всем.
Несмотря на успехи формальной модели атома, она уже не удовлетворяла тому критерию логической простоты, которая производит впечатление очевидности (и которая так выгодно отличала модель Бора). Постепенно она стала настолько сложной, что вызвала недоверие к себе и некоторое чувство усталости, очень похожее на то, какое владело физиками до схемы Бора. К тому же все попытки распространить модель Бора на более сложные атомы кончались неудачей. В состоянии некой растерянности физики стали подвергать сомнению все: справедливость закона Кулона, применимость электродинамики и механики в атомных системах и даже закон сохранения энергии. Все примерно понимали, что кризис этот возник от столкновения эмпирических данных, принципов теории квантов и остатков классических представлений, отказаться от которых пока было нельзя, поскольку взамен их не было предложено ничего определенного.
При изучении квантовых явлений исследователи пользовались по-прежнему классическими понятиями. Но у атомных объектов не было свойств, которые бы этим понятиям соответствовали, и потому природе задавали, в сущности, незаконные вопросы. Или, точнее, вопросы на языке, которого она не понимала. Тогда начались поиски общего принципа, из которого бы логически следовали и формальная модель атома, и другие особенности атомных объектов. «Пусть вначале этот единый принцип будет непонятным, но пусть он будет один» — таково было общее желание.
В ответ на это стремление в том же 1925 году возникла квантовая механика — наука о движении электронов в атоме. Ее создало новое поколение физиков. По игре случая все они родились почти одновременно: Вернер Гейзенберг — в 1901, Поль Адриен Морис Дирак — в 1902, Вольфганг Паули — в 1900 году. Лишь немного старше их были Луи де Бройль и Эрвин Шредингер. Им выпало счастье записать образы и понятия атомной механики на языке формул. Как им это удалось — мы узнаем немного позже.
Термическая утилизация отходов.
|
ПОИСК:
|
При использовании материалов сайта активная ссылка обязательна:
http://nplit.ru/ 'Библиотека юного исследователя'