
Жерар и рациональные формулы
Впервые термин «рациональная формула» ввел Берцелиус (1833) в связи со статьей Либиха и Велера об открытии радикала бензоила. Он писал: «Для большей легкости выражения я буду пользоваться в дальнейшем изложении Двумя видами формул для состава органических веществ. Одни я буду называть эмпирическими, они вытекают из правильного анализа и являются неизменными. Вторые я буду называть рациональными, ибо они дают понятие об обоих электрически противоположных телах, из которых, по нашему воззрению, образован атом (молекула. — М. Ф.)» [27, стр. 184]. Позже рациональные формулы стали иногда называть конституционными.
Жерар уже в первых своих работах пользуется эмпирическими, а не рациональными дуалистическими формулами. В его «Кратком учебнике органической химии» даны только эмпирические формулы, что для того времени было большой смелостью. Эмпирическими формулами пользовались и ранее Жерара (Лоран, Бодримой (Александр Эдуард Бодримой (Baudrimont, 1806-1880) - фармацевт и химик, профессор в Борво (с 1842 г), еде был преемником Лорана. Автор учебников и монографий, в которых уделял много внимания теоретическим вопросам), Дюма), но его формулы отличались от формул предшественников, ибо они были выведены на основе идеи Жерара об одинаковом молекулярном объеме всех веществ в газообразном состоянии и в противоположность формулам Дюма были свободны от всяких гипотетических предпосылок. Здесь следует напомнить, что каждый химик-дуалист изображал рациональные формулы по-своему. Так, Дюма давал этиловому спирту формулу C4H8 + H4O2, Либих — (С4Н10) О, H2O, Берцелиус — (С2Н6)O, Митчерлих — С4H10О2 + Н2, Малагути — С4Н6O + H4 + H2О и т. д. «Только суммарные или эмпирические формулы имеют научное значение, которое нельзя приписывать рациональным формулам, являющимся эфемерным продуктом более или менее богатой фантазии», — писал Жерар [1, стр. 336]. «Если я в своей книге отдал предпочтение эмпирическим формулам, если я в ней применял химические типы, то я это сделал для того, чтобы легче достичь общих законов, независимых от всякой теории о расположении молекул (атомов. — М. Ф.)» [12, стр. IX]. И именно правильные эмпирические формулы помогли Жерару прийти к идее о гомологии как общей закономерности органических веществ, они же послужили ему основой для классификации органических веществ.
Когда Жерар под влиянием Лорана признал важную роль «расположения» атомов в молекуле, он изменил свое отрицательное отношение к рациональным формулам. «В связи с тем, что химики не могут видеть бесконечно малых частичек, — писал ему Лоран, — Вы отбрасываете все попытки, которые были сделаны раньше в этом отношении... Скажите, что идеи о расположении (атомов) Берцелиуса и Дэви и других Вас не удовлетворяют, но не отбрасывайте вообще любую попытку определить это расположение, ибо, независимо от Вас, Вы во многих случаях применяете эту идею. <...> Я хочу вместе с Вами отбросить рациональные [дуалистические] формулы, но при условии, что мы постараемся создать синоптические формулы, указывающие на отношение между различными классами [соединений] и их свойствами. Другие химики будут искать формулы «расположения», и мы сможем их критиковать хотя бы потому, что они не нашли истинной формулы» [9, т. 1, стр. 36].
В «Кратком учебнике» Жерара уже находит отражение влияние взглядов Лорана. Критикуя эмпирические формулы Бодримона, Жерар пишет: «Мы до некоторой степени разделяем мнение Бодримона, но не отклоняем, как это делает он, всякую идею о расположении молекул (атомов. — М. Ф.) <...> Рациональные формулы весьма полезны, когда речь идет о выявлении графическим путем некоторых аналогий в реакциях, некоторых отношений между телами различного состава. Каждый может изменять их по своему желанию в зависимости от того, какое отношение он хочет изобразить, но строить формулы только согласно дуалистическим взглядам — значит придавать им слишком узкое значение, противное духу науки» [12, стр. 11—12]. Далее, подчеркивая, что дуалистическая система связана с такими веществами (радикалами), которые никогда никем не были получены, он добавляет: «Все же нельзя отрицать, что органические молекулы содержат две или несколько обособленных частей, но трудно уточнить графически это различие в расположении атомов» [12, стр. 58].
Жерар, таким образом, хотя и признает значение рациональных формул, относится осторожно к их применению. В своем «Кратком учебнике» он в основном применяет эмпирические формулы, но иногда мы встречаем у него и рациональные формулы веществ, получаемых согласно его правилу остатков. «Когда сложное тело реагирует с другим сложным органическим телом, то в результате этого образуется за счет одного элемента первого тела и другого элемента второго тела вещество весьма простого состава, как, например, вода, хлористый водород, р то время как оставшиеся элементы одного и другого соединений, реагируя, остаются соединенными вместе» [1, стр. 448]. Так, формулу нитробензола он изображает C6H5(NO2), бензамида —
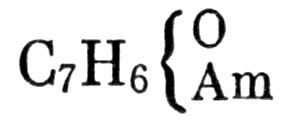
Формула бензамида
(где Am = NH).
Во втором учебнике [16] Жерар начинает называть свою систему химических формул унитарной, подчеркивая тем, что он, в отличие от сторонников дуалистической системы, рассматривает молекулу вещества как единое целое. «По системе, предлагаемой мною, все тела рассматриваются как единые молекулы, атомы которых расположены в определенном порядке; химические реакции указывают на этот порядок только относительно... Из того, что два тела соединяются непосредственно для образования третьего, еще не следует, что и в полученном соединении они будут находиться в том же виде, как и в отдельном состоянии» [16, стр. 30]. Далее он приводит пример образования сульфата бария SO4Ba2. Поскольку это соединение можно получить разными путями, ему можно приписать разную конституцию: 1) SO3 + ОВа2; 2) SO2 + O2Ba2; 3) SBa2 + 2O2.
О расположении атомов в молекуле он пишет: «Знание абсолютного молекулярного расположения в одном теле, очевидно, предполагает значение его и при всех тех метаморфозах, при которых тело образуется. Пока это вещь невозможная (курсив наш. — М. Ф.), нам остается еще много сделать, чтобы это осуществилось. Притом, кроме химических видоизменений, надо изучить физические свойства тел, а именно — отношения, которые существуют между их составом и кристаллической формой. А для этого у нас только несколько отдельных данных, без сомнения драгоценных, но из которых нельзя вывести общих заключений о молекулярном расположении тел. Кристаллографические работы Митчерлиха, Лорана и Коппа уже обогатили науку и дают возможность предчувствовать близкое разрешение этих вопросов (курсив наш. — М. Ф.)» [16, стр. 32]. Таким образом, Жерар не отрицал принципиальной возможности определить расположение атомов, как и раньше, подразумевая под этим физическое расположение атомов в молекуле.
Жерар признавал, существование определенных групп атомов в молекуле, которые переходят из одной молекулы в другую без изменения. Солями, двучленами, двойными или парными телами он называет все химические соединения, составленные из двух частей — металлической и неметаллической; при двойном разложении части могут меняться местами следующим образом:

При двойном разложении части могут меняться местами
Здесь Жерар подчеркивает, что рассматривает две части в молекуле NM не электрохимически расчлененными, что такое раздвоение проявляется только при реакциях, а в молекуле все атомы образуют единое целое. Он говорит о сохранении групп SO4, NO3 и др. и допускает существование металлических групп (например, группы NH4), которые тоже сохраняются после реакции двойного разложения.
Жерар указывает на взаимное влияние атомов в молекуле: «Роль металла и неметалла не зависит единственно от природы элемента, но и от его количества, равно и от природы и количества тех элементов, с которыми он соединен (курсив наш. — М. Ф.). Элемент, который обыкновенно бывает металлом, может в другом соединении вести себя как неметалл» [16, стр. 52]. В качестве примера он приводит роль атома железа в обычных солях и в железистосинеродистом калии. Атомы водорода в органических соединениях обладают двоякими химическими функциями: металептическими (замещаются атомами галогенов) и металлическими (замещаются атомами металлов). В органических кислотах имеются и «металлический» и металептический водород; например, в уксусной кислоте три атома водорода металептические, а четвертый атом — металлический. В этих высказываниях вновь проявляется мысль о взаимном влиянии атомов, отрицательное отношение Жерара к концепции дуалистов о неизменности природы атомов.
Говоря о группах неметаллов (Gl, Br, J; О, S, Se; N, Р, As), Жерар указывает, что элементы одной и той же группы эквивалентны между собой, а элементы разных групп — неэквивалентны. Например, один атом О или S эквивалентен 2Н и 2C1; один атом азота эквивалентен ЗН, группа NH эквивалентна О [9, т. I, стр. 51]. Здесь под влиянием Лорана Жерар признает, что некоторые металлы имеют два эквивалента (например, железо). Во всем этом содержится зародыш понятия валентности элементов. Правило четности числа атомов водорода в органических соединениях выражает идею о четном числе единиц валентности в соединении.
В теоретической работе, сделанной вместе с Шанселем [45], Жерар признает, что если в своем «Precis» он пользовался главным образом эмпирическими формулами, то теперь он перешел к рациональным формулам, которые выражают реакции получения веществ, указывают на остатки, из которых вещества образовались. Эти формулы не имеют ничего общего с рациональными формулами дуалистов, так как не показывают расположения атомов в электрохимическом смысле.
Жерар отмечает, что его рациональные формулы (по предложению Лорана он называет их синоптическими) являются сокращенными уравнениями реакции. Например, свою рациональную формулу карбоната этиламмония он сопоставляет с рациональной формулой этого же соединения, данной Берцелиусом [1, стр. 390].
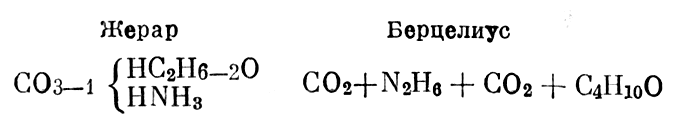
Свою рациональную формулу карбоната этиламмония он сопоставляет с рациональной формулой этого же соединения, данной Берцелиусом
Если формулу Жерара несколько упростить:
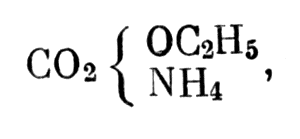
Если формулу Жерара несколько упростить
мы получим формулу, мало отличную от современной. То же самое относится и к жераровской формуле мочевины
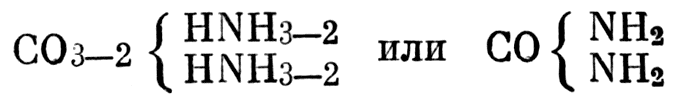
То же самое относится и к жераровской формуле мочевины
Формулы Жерара говорят о том, что данные вещества образуются в результате выделения воды из соответствующих веществ и соединения получающихся при этом остатков [46]. С другой стороны, они указывают на определенную группировку атомов. И эти группировки во многих случаях соответствовали реальным, хотя сам Жерар это отрицал. По мнению Жерара, установить конституцию — значит установить не расположение атомов в молекуле, а гомологический ряд, к которому принадлежит данное вещество, и место, которое оно занимает в ряду и во всей системе классификации.
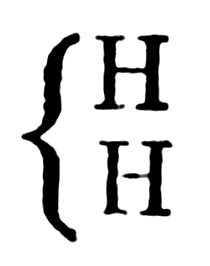
В рассматриваемой работе Жерар дает первый набросок теории типов. Он называет углеводороды гомологами водорода
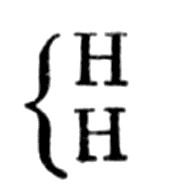
Он называет углеводороды гомологами водорода
считая, что их формулы можно получить, прибавляя к атому водорода nСН2, где n = 1, 2, 3...
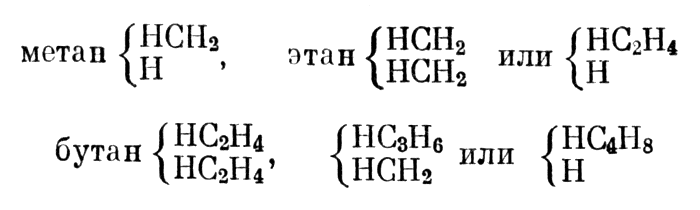
Жерар ошибочно предсказывал существование двух изомеров этана и трех — бутана
Исходя из этого предположения, Жерар ошибочно предсказывал существование двух изомеров этана и трех — бутана, хотя в принципе он был прав, указав на возможность существования изомеров углеводородов. Между прочим, он предсказал еще не известные «смешанные радикалы», открытые позже Вюрцем.
В «Курсе органической химии» Жерар подробно останавливается на относительности рациональных формул: «Химические формулы выражают и могут выражать только отношения, аналогии; наилучшие формулы это те, которые выражают больше таких отношений и больше аналогий» [20, IV, стр. 563]. Однако он признает, что формулы могут указывать на наличие каких-то групп атомов в молекуле, и называет эти группы радикалами, подчеркивая их отличие от дуалистических радикалов: «Я называю радикалом или остатком элементы всякого тела, которые могут быть перенесены в другое тело в результате реакции двойного разложения или были введены в это тело подобной реакцией. Так, хлористый бензоил, ангидрид бензойной кислоты, бензамид содержат радикал C7H5O (бензоил); аммиак, вода, едкое кали содержат радикал Н (водород) <...> Как видно из всего этого, в противоположность большинству химиков, я понимаю понятие «радикал» как отношение, а не как тело, которое можно получить в свободном виде или которое существует в свободном виде» [20, IV, стр. 568].
Если объективно понятие радикала в интерпретации Жерара соответствовало определенной, относительно неизменчивой обособленной группе атомов в молекуле, то нельзя сказать, что и сам Жерар именно так рассматривал свои радикалы, По его мнению, каждая рациональная формула вещества соответствует только одному способу его получения; при получении другим способом рациональная формула меняется — меняются и радикалы. Кроме того, Жерар изменял рациональные формулы в зависимости от того, в какие химические реакции вступает данное вещество. При переходе к своей теории типов он часто подчеркивал это, указывая, что любое соединение можно сматривать как производное разных типов. Например, альдегиды он считал производными соединении рода
альдегиды он считал производными соединении рода
и типа воды
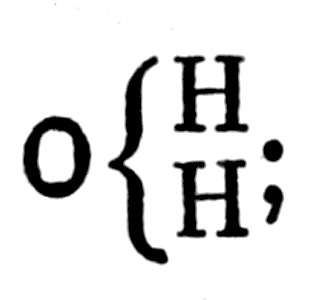
И типа воды
исходя из этого, уксусный альдегид он изображал
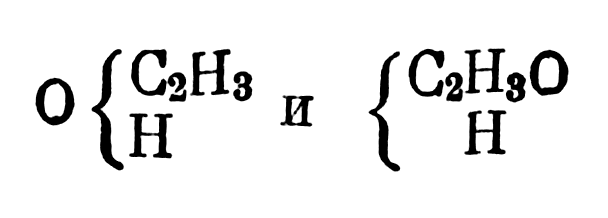
Уксусный альдегид он изображал
Теория типов Жерара является важным шагом в обобщении и развитии его унитарной системы. Открытия Франкланда, Вюрца, Гофмана, Вильямсона, Шанселя и Жерара (1848-1852) способствовали ее утверждению, но одновременно требовали интерпретации новых фактов. Рациональные формулы должны были объяснять генетическую связь между различными соединениями, а также предсказывать существование еще не известных веществ. Теория типов Жерара - это итог развития органической химии за десятилетие, считая с первого выступлен Жеpapa со своей новой системой химических обозначений.
Основные положения теории Жерар изложил в статье об ангидридах органических кислот [47]. «Органические соединения могут быть сведены к трем или четырем типам: каждый из них способен давать ряды (гомологические. - М. Ф.), подобные тем, к которым принадлежат муравьиная и стеариновая кислоты; этими типами являются вода Н2O; водород Н2; хлористый водород НСl; аммиак NH3. Обменивая свой водород на определенные группы, эти типы дают начало кислотам, спиртам, эфирам, гидридам, радикалам, органическим хлоридам, кетонам, щелочам» [47,стр. 902].
Жерар отличает положительные одноатомные радикалы, замещающие один атом водорода в перечисленных типах; они дают соединения, имеющие основной (или нейтральный) характер. Эти спиртовые радикалы подобны металлу калию, дающему гидроокись и окись калия
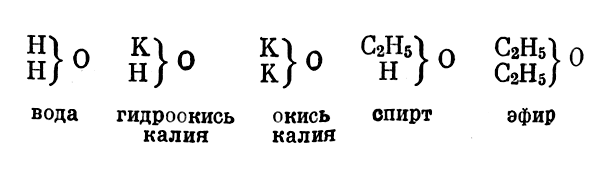
Эти спиртовые радикалы подобны металлу калию, дающему гидроокись и окись калия
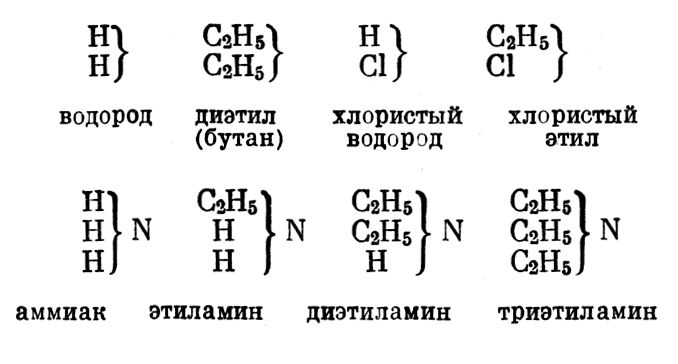
Отрицательные радикалы происходят от спиртовых радикалов путем замещения двух атомов водорода одним атомом кислорода
Отрицательные радикалы происходят от спиртовых радикалов путем замещения двух атомов водорода одним атомом кислорода. Они также способны замещать один атом в соответствующем типе и дают соединения с кислотными свойствами:
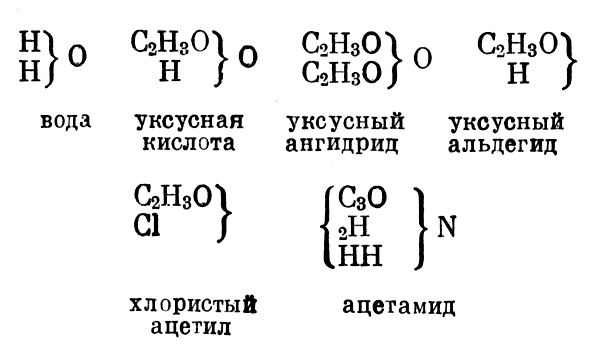
Они также способны замещать один атом в соответствующем типе и дают соединения с кислотными свойствами
Кроме этих соединений, существуют промежуточные (нейтральные) соединения, которые образуются при замещении атомов водорода в типе воды и типе водорода одним положительным и одним отрицательным радикалом. Например:
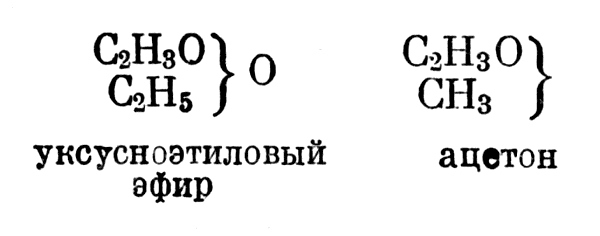
Существуют промежуточные (нейтральные) соединения
В «Traite» Жерар расширяет теорию типов: «Тип воды включает окислы (основания, кислоты, соли, спирты и т. д.), сульфиды, селениды и теллуриды, тип хлористого водорода — хлориды, фториды, бромиды, иодиды и цианиды; тип аммиака — азотиды и фосфиды; тип водорода — металлические гидриды и металлы» [20, IV, стр. 589].
Еще в 1852 г., развивая идеи Вильямсона, Жерар предложил, помимо обычных типов, еще удвоенные и утроенные. «Двухосновные кислоты являются двумя молекулами воды Н4O2, в которых половина водорода вамещена сложной группой. Трехосновные кислоты являются тремя молекулами воды Н6O3, в которых половина водорода замещена
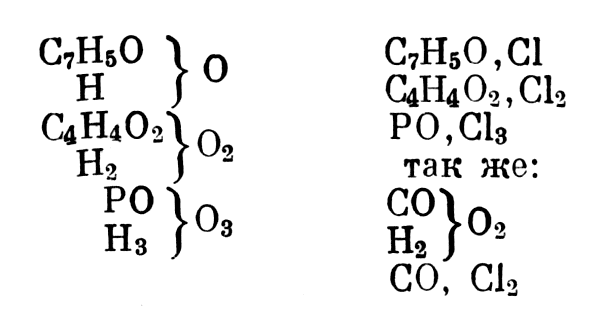
Трехосновные кислоты являются тремя молекулами воды Н6O3, в которых половина водорода замещена
СО замещает Н2, РО замещает Н3. Это может вести далеко» [1, стр. 404]. Таким образом, Жерар различает одноатомные, двухатомные и трехатомные радикалы, замещающие один, два, три атома водорода.
Типические формулы Жерара объективно отражали основную закономерность элементов, их валентность. Сам Жерар и не выявил это свойство, но он подготовил почву для возникновения понятия «валентность». Первый шаг в этом направлении он сделал, введя правильные эмпирические формулы органических и простейших неорганических соединений. Вместе с Лораном Жерар на основе реакций замещения устанавливает, что галогены эквивалентны одному Н, О и S — двум, а N и Р — трем атомам водорода. Вторым шагом можно считать установление того факта, что радикалы тоже имеют определенную эквивалентность и играют ту же роль, что и элементы. Это сблизило органические и неорганические соединения, способствовало установлению четырехвалентности атома углерода и в неорганических и в органических соединениях.
Среди типических формул Жерара можно встретить составные радикалы, в частности радикалы кислот. Так, формула уксусной кислоты имела у него два вида:
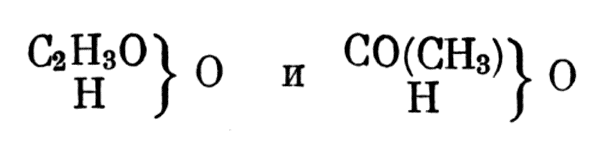
Формула уксусной кислоты имела у него два вида
Радикалы муравьиной, пропионовой, масляной кислоты он изображал так: СО(Н) = формил, СО(С2Н5) = иропионил, СО(С3Н7) = бутирил. В этих формулах уже содержится мысль о четырехатомности углерода в органических соединениях и о наличии в органических кислотах карбонильной группы.
Типы и типические формулы Жерара объективно отражали связь между атомами водорода и атомом кислорода
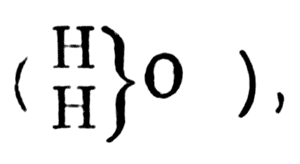
Связь между атомами водорода и атомом кислорода
атомами водорода и атомом азота
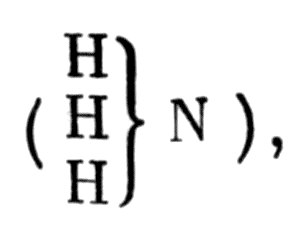
Атомами водорода и атомом азота
а также между атомами водорода в молекуле Н2 и между атомами хлора в молекуле Сl2. «Изучение реакций приводит к изображению газа водорода двумя радикалами НН, а газа хлора - двумя радикалами СlСl. В современной номенклатуре газ водород - это гидрид водорода, а газ хлор - хлорид хлора; это значит, что как газ хлор, так и газ водород получаются в результате реакции двойного разложения, точно так же, как и те реакции, которые привели к тому, что мы называем горькоминдальное масло гидридом бензоила, а хлорированное соединение этого масла - хлоридом бензоила» [20, т. IV, стр. 568].
Интересно отметить, что Жерар рассматривает газ азот как третичный амин N}N, в котором все атомы водорода аммиака замещены атомом азота, и называет его азотидом азота. Этим он молчаливо признает наличие трех связей между атомами азота в его молекуле. Таким образом, Жерар догадывался о связи и между различными и между одинаковыми атомами и, кроме того, о связи между атомами водорода, хлора, кислорода, азота, с одной стороны, и радикалами, замещающими атомы водорода в типических формулах, с другой. Но следует признать, что, допуская для одного и того же вещества разные типические формулы, он приходил к неправильным, неоднозначным выводам.
Все эти предположения о химической связи, в скрытом ивде содержавшиеся в типах Жерара, были впоследствии развиты Кекуле.
Типические формулы Жерара по-новому поставили вопрос о химических функциях соединений. Если в его первой системе классификации свойства соединений гомологических рядов связаны с количественным составом, выраженным эмпирически, то, исходя из типических формул, Жерар показывает, что данные свойства зависят не только от типа исходного соединения, но и от радикала (или элемента), замещающего атом водорода в данном типе. Это оясняет, почему изменчивая часть молекулы соединения чаще всего является остатком типа (или, точнее, «типическим» водородом), а относительно устойчивая часть молекулы-радикалом, замещающим атом водорода. Из теории типов следовало, что «металлический» водород принадлежит типу, а «металептический» водород - радикалу, замещающему водород в типовой формуле. Тем самым косвенно выяснилось особое значение гидроксильной группы
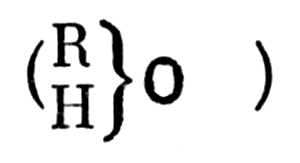
Особое значение гидроксильной группы в органических соединениях
в органических соединениях.
Типические формулы до некоторой степени указывали на функциональные группы соединений, а также на зависимость лабильности «типического» атома водорода от природы радикала типической формулы.
Для изображения типических формул многоосновных кислот Жерар пользовался кратными типическими формулами; метамеры некоторых соединений, например хлористый салицил и хлорбензойную кислоту, он изображал следующим образом:

Метамеры некоторых соединений, например хлористый салицил и хлорбензойную кислоту, он изображал следующим образом
Из первой формулы видно, что в соединении имеется альдегидная группа, вторая формула подчеркивает кислотные свойства хлорбензойной кислоты. Однако в первом случае не указывается на наличие в хлористом салициле гидроксильной группы.
Типические формулы Жерара не могли выразить конституцию многофункциональных химических соединений. Типические формулы получались весьма относительными, ибо они исходили только из реакции замещения (двойного разложения), причем одно и то же соединение часто изображалось несколькими формулами. Иногда типические формулы отражали скрыто химическое строение, но их нельзя назвать формулами строения, так как они не опирались на химические связи между атомами и не были связаны с понятием «валентность», которого тогда вообще не существовало. Вполне естественно, что и сам Жерар не придавал им абсолютно однозначного значения, так как не допускал мысли, что типические формулы могут отобразить «расположение» атомов в молекуле, которое он понимал как трехмерное геометрическое расположение, а не как взаимные связи между атомами. Этого понятия еще не было в химии.
|
ПОИСК:
|
© NPLIT.RU, 2001-2021
При использовании материалов сайта активная ссылка обязательна:
http://nplit.ru/ 'Библиотека юного исследователя'
При использовании материалов сайта активная ссылка обязательна:
http://nplit.ru/ 'Библиотека юного исследователя'